
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
(1)Ⅰ.脱硝:已知:H2的燃烧热为285.8kJmol﹣1
N2(g)+2O2(g)=2NO2(g)△H=+133kJmol﹣1
H2O(g)=H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
(2)Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2 , 在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)CH3OH(l)+H2O(l)
(I)①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 .
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H﹣H键断裂
(II)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.负极发生的电极反应式是
【答案】
(1)4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1100.2kJ?mol﹣1
(2)低温;de;2CH3OH+2H2O﹣12e﹣═12H++2CO2
【解析】解:(1)Ⅰ. 已知:H2的热值为142.9KJg﹣1 , 燃烧热为285.8KJ/mol,
①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8KJ/mol
O2(g)=H2O(l)△H=﹣285.8KJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=+133kJmol﹣1
③H2O(g)=H2O(l)△H=﹣44kJmol﹣1
①×4﹣②﹣③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1100.2kJmol﹣1;
所以答案是:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=﹣1100.2kJmol﹣1;
2)Ⅱ.(I)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△H﹣T△S<0
所以答案是:低温;②CO2(g)+3H2(g)═CH3OH(l)+H2O(l),
a、混合气体的平均式量始终保持不变,不能说明反应达到平衡状态,故a错误;
b、向2L密闭容器中加入2mol CO2、6mol H2 , 按照1:3反应,所以过程中CO2和H2的体积分数始终保持不变,故b错误;
c、向2L密闭容器中加入2mol CO2、6mol H2 , 按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故c错误;
d、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故d正确;
e、1mol CO2生成的同时有3mol H﹣H键断裂,说明正逆反应速率相同,反应达到平衡状态,故e正确;
所以答案是:d e;(II)甲醇燃料电池工作时,原电池中负极上燃料甲醇失电子发生氧化反应:2CH3OH+2H2O﹣12e﹣═12H++2CO2 , 所以答案是:2CH3OH+2H2O﹣12e﹣═12H++2CO2 .
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.200molL-1的稀盐酸。可供选用的仪器有:A胶头滴管;B量筒;C烧杯;D天平;E玻璃棒。
①配制稀盐酸时,上述仪器中不需要使用的有 (选填字母),还缺少的仪器有__________。
②该学生需要用__________mL量筒量取__________mL上述浓盐酸进行配制。
③配制稀盐酸时,在洗涤操作中,将洗涤液全部移入容量瓶,其目的是__________。
④配制稀盐酸时,在定容操作中,应在距刻度线__________处,改用胶头滴管滴加蒸馏水至液面与__________。
⑤若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)定容时俯视刻度线__________;定容后经振荡、摇匀、静置,发现液面下降,再加适合的蒸馏水__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不可能通过观察法了解的金属钠的性质是 ( )
A.钠是一种银白色金属
B.熔点为97.81 ℃,密度为0.97 g·cm-3
C.钠与H2O剧烈反应
D.钠室温下氧化和在空气中燃烧得到不同的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( ) 
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关共价分子的说法正确的是( )
A.都是极性分子
B.都是共价化合物
C.共价分子间的作用力都比化学键弱
D.溶于水的共价分子都能产生自由移动的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学以反应2Fe3++2I﹣2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响.实验如图1: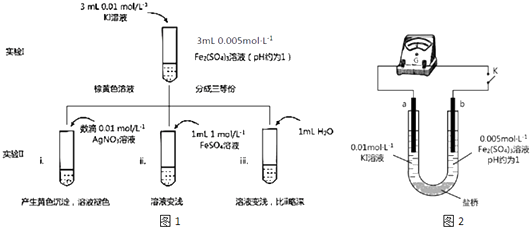
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 .
(2)iii是ii的对比试验,目的是排除有ii中造成的影响.
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因: .
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I﹣)降低,导致I﹣的还原性弱于Fe2+ , 用图2装置(a、b均为石墨电极)进行实验验证.①K闭合时,指针向右偏转,b作极.
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01molL﹣1 AgNO3溶液,产生的现象证实了其推测,该现象是 .
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因①转化原因是 .
②该实验与(4)实验对比,不同的操作是 .
(6)实验I中,还原性:I﹣>Fe2+;而实验II中,还原性:Fe2+>I﹣ , 将(3)和(4)、(5)作对比,得出的结论是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com