
 NH3+H2O,则n(OH-)=n(NH3)=
NH3+H2O,则n(OH-)=n(NH3)=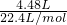 =0.2 mol即2a=0.2mol,a=0.1mol,所以n(OH-)=0.2mol,
=0.2 mol即2a=0.2mol,a=0.1mol,所以n(OH-)=0.2mol, MO+CO2↑
MO+CO2↑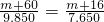 ,解得:m=137,故答案为:137;
,解得:m=137,故答案为:137; NH3+H2O来计算;
NH3+H2O来计算; MO+CO2↑来计算;
MO+CO2↑来计算;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)M的氢氧化物与NaHCO3反应的化学方程式为:?
。?
(2)要计算M的相对原子质量,你认为还必须提供下列哪项数据 (填字母序号)。
A.M的氢氧化物溶液的物质的量浓度(设为2 mol·L-1?)?
B.M的碳酸盐的质量(设为39.4 g)?
C.与M的碳酸盐反应的盐酸的物质的量浓度(设为0.1 mol·L-1?)?
D.题设数据充足,不需要补充数据?
根据你的选择,计算金属M的相对原子质量是 。?
(3)请计算与滤液反应的盐酸的物质的量浓度是 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属M的氢氧化物的结晶水合物M(OH)2·xH2O与Na2CO3的混合物共36.800 g,加入足量的水后,生成白色沉淀(沉淀不含结晶水),将沉淀滤出,洗净烘干,称得其质量为9.850 g。将得到的沉淀高温灼烧后,质量变为7.650 g;滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48 L气体(标准状况)。求:
⑴滤液中OH-的物质的量为__________mol。
⑵若M的中子数为81,则M的元素符号为____________。
⑶M的氢氧化物的结晶水合物的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属M的氢氧化物的结晶水合物M(OH)2·xH2O与Na2CO3的混合物共36.8g,加入足量的水后,生成白色沉淀(沉淀中不含结晶水),将沉淀过滤、洗涤、烘干,称得其质量为9.85g,将得到的沉淀高温灼烧后,质量变为7.65g,滤液与酸作用不产生气体,若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况)。
(1)滤液中n(OH-)=____________mol
(2)M的相对原子质量_____________________
(3)M的氢氧化物的结晶水合物的化学式为____________________
(4)将M的此氢氧化物与NH4Cl置右图所示装置(玻璃片中与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,玻璃片将___________________,与该反应对应的能量变化关系图是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com