
����Ŀ�������ǶԻ�ѧ��Ӧ�仯���̼�������о�����Ҫ��ش����⣺
��1����֪���״���ˮ��Ӧ2CH3OH��g��=CH3OCH3��g��+H2O��g����H1=��23.9kJmol��1
�״���ϩ����Ӧ2CH3OH��g��=C2H4 ��g��+2H2O��g��D��H2=��29.1kJmol��1
�Ҵ��칹����ӦC2H5OH��g��=CH3OCH3��g����D��H3=+50.7kJmol��1
����ϩ����ֱ��ˮ�Ϸ�Ӧ��C2H4 ��g��+H2O��g��=C2H5OH��g���ġ�H= ��
��2����25���£���pH=a������������Һ��pH=b�Ĵ�����Һ�������ϣ�������Һǡ����ȫ��Ӧ����a+b14�������������=���������¶��´���ĵ��볣��K=���ú�a��b��ʽ�Ӿ�ȷ��ʾ��
��3����һ�����ӷ���ʽ��ʾ��Ӧ��100ml 3molL��1NaOH��Һ��ͨ���״����4.48LCO2��������Һ������Ũ�ȴ�С����˳��Ϊ����
��4���ϰ�ˮ����ת���ɰ���������Ƴɼ���ȼ�ϵ�أ�ͼ�Ǹ�ȼ�ϵ��ʾ��ͼ��������X�����ֱ���ŷŵ������У�a�缫�缫��ӦʽΪ��T���£�ij�о�Ա�ⶨNH3H2O�ĵ��볣��Ϊ1.8��10��5 �� NH4+��ˮ��ƽ�ⳣ��Ϊ1.5��10��8��ˮ��ƽ��Ҳ��һ�ֻ�ѧƽ�⣬��ƽ�ⳣ����ˮ�ⳣ����������¶���ˮ�����ӻ�����Ϊ �� ���ж�T25�棨�������������=���� 
���𰸡�
��1����45.5kJ/mol
��2������![]()
��3��3OH��+2CO2�TCO32��+HCO3��+H2O��C��Na+����C��HCO3������C��CO32������C��OH������C��H+��
��4��2NH3+6OH����6e��=N2+6H2O��2.7��10��13����
���������⣺��1.����֪���״���ˮ��Ӧ ��2CH3OH��g���TCH3OCH3��g��+H2O��g����H1=��23.9kJmol��1�״���ϩ����Ӧ ��2CH3OH��g���TC2H4��g��+2H2O��g����H2=��29.1kJmol��1�Ҵ��칹����Ӧ ��C2H5OH��g���TCH3OCH3��g����H3=+50.7kJmol��1 �� ���ݸ�˹���ɢ٩��ک��ۿɵã�C2H4��g��+H2O��g���TC2H5OH��g����H=����23.9+29.1��50.7��kJ/mol=��45.5kJ/mol�����Դ��ǣ���45.5kJ/mol��
��2.��pH=a������������Һ��c��NaOH��=c��OH����=10a��14mol/L�����Ჿ�ֵ��룬��pH=b�Ĵ�����Һ��c�����ᣩ��10��bmol/L�����ǡ���кͣ���������ʵ����������ʵ�����ȣ���c��NaOH��=c��OH����=10a��14mol/L=c�����ᣩ��10��bmol/L������10a��14��10��b �� ��a+b��14��c�����ᣩ=c��NaOH��=10a��14mol/L��c��H+��=c��CH3COO����=10��bmol/L�������ĵ��볣��K= ![]() =
= ![]() =
= ![]() �����Դ��ǣ�����
�����Դ��ǣ����� ![]() ��
��
��3.��100mL 3molL��1��NaOH�����ʵ���=3mol/L��0.1L=0.3mol����״����4.48LCO2�����ʵ���= ![]() =0.2mol������OH����2CO2=3��2�����ӷ���ʽΪ��3OH��+2CO2�TCO32��+HCO3��+H2O����Ӧ�����Һ����0.1mol��NaHCO3��0.1mol��Na2CO3 �� ����̼���ƻ���̼�����ƣ���Һ���ʼ��ԣ�����C��OH������C��H+������Һ��������������������Դ��һ����̼�������ˮ�⣬һ����̼���������ˮ�⣬̼�������ˮ��̶ȴ���̼��������ӵ�ˮ�⣬����C��HCO3������C��CO32������C��OH����������Һ�и�����Ũ�ȴ�С˳����C��Na+����C��HCO3������C��CO32������C��OH������C��H+�������Դ��ǣ�3OH��+2CO2�TCO32��+HCO3��+H2O��C��Na+����C��HCO3������C��CO32������C��OH������C��H+����
=0.2mol������OH����2CO2=3��2�����ӷ���ʽΪ��3OH��+2CO2�TCO32��+HCO3��+H2O����Ӧ�����Һ����0.1mol��NaHCO3��0.1mol��Na2CO3 �� ����̼���ƻ���̼�����ƣ���Һ���ʼ��ԣ�����C��OH������C��H+������Һ��������������������Դ��һ����̼�������ˮ�⣬һ����̼���������ˮ�⣬̼�������ˮ��̶ȴ���̼��������ӵ�ˮ�⣬����C��HCO3������C��CO32������C��OH����������Һ�и�����Ũ�ȴ�С˳����C��Na+����C��HCO3������C��CO32������C��OH������C��H+�������Դ��ǣ�3OH��+2CO2�TCO32��+HCO3��+H2O��C��Na+����C��HCO3������C��CO32������C��OH������C��H+����
��4.����ȼ�ϵ���У���ȼ����븺����������NH3�����a����������������X����Ϊ���������ֱ���ŷŵ������У�˵��X�Դ�������Ⱦ�����XΪ�������ɸ�ȼ�ϵ��ʾ��ͼ��֪������Ӧ������ˮ�������Ǽ��Ե�أ�����������Ҳ���븺���缫��Ӧ������������д��������Ӧʽ��2NH3+6OH����6e��=N2+6H2O�����ݹ�ʽKw=Kh��Kb��T����Kw=1.5��10��8��1.8��10��5=2.7��10��13��ˮ�ĵ��������ȵģ������¶�Խ��KwԽ������2.7��10��13��1.0��10��14 �� ����T��25�棬���Դ��ǣ�2NH3+6OH����6e��=N2+6H2O��2.7��10��13������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������ʡ������������˳��������ȷ����(����)
A. ϡ�����塢���ء���ˮ����� B. �Ҵ���Ũ���ᡢ����
C. ���ʯ������ʯ������ʯ D. ˮ����ˮ������ˮú��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾʵ��װ�ü�˵������ȷ���ǣ� �� 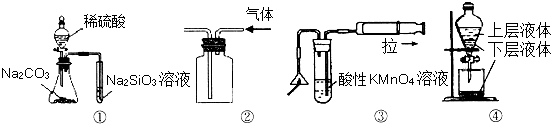
A.��ͼ����ʾʵ��ɱȽ���̼��������Ԫ�صķǽ�����ǿ��
B.��ͼ����ʾʵ��װ���ſ������ռ�CO2����
C.��ͼ�ۿ��Լ�����ȼ�����ɵ�SO2����
D.��ͼ����ȡ�����еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeC13��CuCl2�Ļ��Һ�м������ۣ���ַ�Ӧ�����й�����ڣ��������жϲ���ȷ��( )
A. ����KSCN��Һһ�������ɫ B. ��Һ��һ����Fe2+
C. ��Һ��һ������Cu2+ D. ʣ�������һ����Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�л���A��B��C��D��E����ͼ��ʾת����ϵ�� 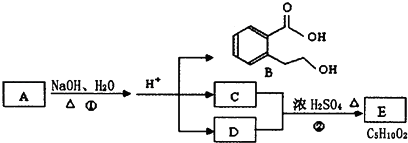
����C�ܸ�NaHCO3������Ӧ��C��D����Է���������ȣ���EΪ��֧���Ļ����������ͼ�ش����⣺
��1��B�����еĺ�����������������
д��һ��ͬʱ���������ĸ�������B��ͬ���칹��Ľṹ��ʽ ��
a���������ṹ��ȡ����λ�ڼ�λ b���ܷ���ˮ�ⷴӦ
c���ܷ���������Ӧ d����FeCl3��Һ������ɫ��Ӧ��
��2��д���ڵķ�Ӧ����ʽ�� ��
��3��д��D��Ũ�����ڼ��������·����ķ�Ӧ ��
��4��A�ĽṹͲʽ�� ��
��5����B���ӣ��������Ӽ���ˮ������������Ӧ���ɸ߷��ӵĽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�����ʢ��ǿ��ԭ��Һ̬��(N2H4)��ǿ������Һ̬˫��ˮ�������ǻ�Ϸ�Ӧʱ������������������ˮ���������ų��������ȡ���֪0.4 molҺ̬����������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.652 kJ��������
(1)�˷�Ӧ���Ȼ�ѧ����ʽΪ________________��
(2)����֪H2O(g)===H2O(l) ��H����44 kJ��mol��1��16 gҺ̬��������Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų�������Ϊ________kJ��
(3)�˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ���________________________________��
(4)�������ǿ�����̬��(N2H4)��ȼ�ϣ����������������������߷�Ӧ���ɵ�����ˮ��������֪��
N2(g)��2O2(g)===2NO2(g) ��H����67.7 kJ��mol��1
N2H4(g)��O2(g)===N2(g)��2H2O(g) ��H����534 kJ��mol��1
��̬�ºͶ���������Ӧ���Ȼ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Т�MgSO4����Ba(NO3)2����NaOH����CuCl2������Һ�����������Լ����ɼ��������������Ⱥ�˳����(����)
A. �ۢܢڢ� B. �ۢܢ٢�
C. �ڢ٢ۢ� D. �ܢۢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƶ�˼ά�����ڻ�ѧѧϰ���о��г����������Ľ��ۣ�������ƵĽ�������Ҫ����ʵ���ļ������ȷ�����Ƿ���ȷ�����м������ƽ�������ȷ���ǣ� ��
A.��2Cu+O2 ![]() 2CuO���Ƴ�ͬ�����Ҳ��Cu+S
2CuO���Ƴ�ͬ�����Ҳ��Cu+S ![]() CuS
CuS
B.Fe3O4�ɱ�ʾΪFeO?Fe2O3 �� ��Pb3O4�ɱ�ʾΪPbO?Pb2O3
C.Na����ˮ��Ӧ����H2 �� K��CaҲ����ˮ��Ӧ����H2
D.CO2��Na2O2��Ӧֻ����Na2CO3��O2 �� ��SO2��Na2O2��Ӧֻ����Na2SO3��O2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com