
分析 (1)生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;2MnCO3+O2═2MnO2+2CO2为方程①②之和,所以K=K1×K2;
(2)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;
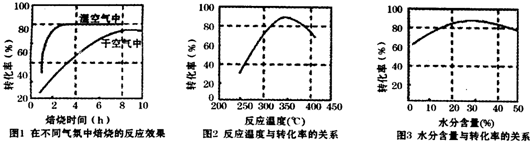
(3)由图分析在在指定温度下和水分含量下碳酸锰转化率要高;
(4)阳极发生氧化反应,锰由+2价变成+4价,产生大量的氢离子.
解答 解:(1)反应①的平衡常数表达式K1=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$=$\frac{({P×\frac{{n}_{1}}{{n}_{1}+{n}_{2}})}^{2}}{P×\frac{{n}_{2}}{{n}_{1}+{n}_{2}}}$=$\frac{P{{n}_{1}}^{2}}{{n}_{2}({n}_{1}+{n}_{2})}$,K与反应①、②的平衡常数K1、K2关系为:2MnCO3+O2═2MnO2+2CO2为方程①的系扩大2倍后与②之和所以K=K12×K2,
故答案为:=$\frac{P{{n}_{1}}^{2}}{{n}_{2}({n}_{1}+{n}_{2})}$;K=K12×K2;
(2)反应②在低温下能,只有△H<0,△G<0反应自发,
故答案为:<;
(3)由图2分析,在350℃左右碳酸锰转化率比较高,由图3可知水分含量的30%左右碳酸锰转化率比较高(或20%-40%都正确),
故答案为:350℃;含水量30%;
(4)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,产生大量的氢离子,电解后溶液的pH将减小,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;减小.
点评 本题考查化学平衡常数的含义,平衡移动、电化学相关知识,题目难度中等,试题综合性强,学生要有一定的化学基本功才能解决,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 2P1>P2 | B. | 2P1=P2 | C. | 2P1<P2 | D. | P1>P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
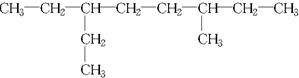
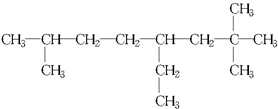
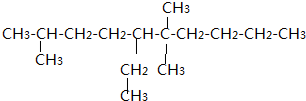 .
.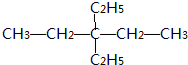 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
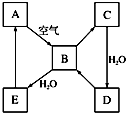 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2+O2=2H2O△H=+285.8 kJ•mol-1 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨不及金刚石稳定 | |
| C. | 在稀溶液中:H++OH-=H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+(2×283.0 )kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com