
【题目】下列说法正确的是
A. H2SO4 和Ca(OH)2含有化学键类型相同
B. 水分子很稳定,是因为水分子的分子间作用力强
C. 二氧化碳和乙烯的碳原子的最外电子层都具有8电子稳定结构
D. 冰和水晶都是分子晶体
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】利用下列反应:![]() 设计一个原电池,请选择适当的材料和试剂。
设计一个原电池,请选择适当的材料和试剂。
I.![]() 请写出你选用的正极材料、负极材料、电解质溶液
请写出你选用的正极材料、负极材料、电解质溶液![]() 写化学式
写化学式![]() :正极为_____________ ,电解质溶液:_____________ ;
:正极为_____________ ,电解质溶液:_____________ ;
![]() 负极反应式: ____________________;
负极反应式: ____________________;
![]() 溶液中
溶液中![]() 向 __________ 极移动。
向 __________ 极移动。
II.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
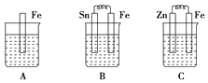
(1)B中Sn极的电极反应式为_________________。
(2)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积0.1mol/L醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是( )
A.溶液的pH值变小
B.醋酸的电离程度降低
C.溶液的导电能力减弱
D.中和此溶液所需的0.1mol/LNaOH溶液的体积增加
查看答案和解析>>
科目:高中化学 来源: 题型:
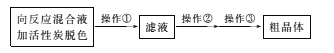
【题目】通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是
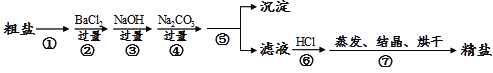
A. 实验过程中①、⑤步骤的操作分别是溶解、过滤
B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+
C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
D. 实验过程中②、④步骤互换,对实验结果不影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知X原子的最外层电子数为4。下列说法正确的是
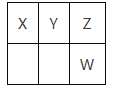
A. 元素Z的主要化合价:-2、+6
B. 原子半径:X>Y>Z
C. 最低价气态氢化物的稳定性:W>Z
D. 最高价氧化物对应的水化物的酸性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业上制取硫代硫酸钠晶体,反应装置和试剂如下图:
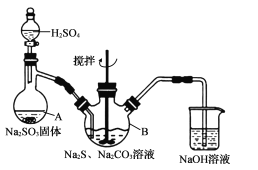
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通人Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
回答下列问题:
(l)仪器A的名称是____,Na2S的电子式为____。
(2)三颈烧瓶B中制取Na2S203反应的总化学方程式为_______________
(3)从上述生成物混合液中获得较高产率Na2S2O3.5H2O的步骤为
为减少产品的损失,操作①为趁热过滤,“趁热”的目的是____;操作②是____;操作③是抽滤、洗涤、干燥。
(4)测定Na2S203.5H2O纯度取6.00 g产品,配制成100 mL溶液。取10. 00 mL溶液,以淀粉溶液为指示剂,用浓度0. 0500 mol/L的标准溶液进行滴定,反应原理为2S2O32-+I2![]() S4O62-+2I-,相关数据记录如下表所示。
S4O62-+2I-,相关数据记录如下表所示。
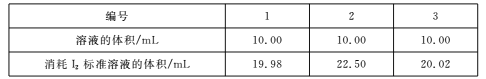
Na2S2035H20的纯度为____%(保留1位小数)。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:

请回答:
(1)仪器a的名称是_____________。
(2)装置B中冰水的作用是_________。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是______。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)X、Z两种元素的元素符号为X________,Z________。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________________。
(3)①由X、Y、Z所形成的常见离子化合物是__________________(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______。
③化合物WY3的晶体结构中含有的化学键为________(选填序号)。
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应生成X2,其中水作________(填“氧化剂”或“还原剂”)。
(4)用电子式表示化合物W2Z的形成过程:______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com