
| 1 | 2 |
| 1 |
| 2 |
| 5 |
| 2 |
| 1 |
| 16 |
| 1 |
| 26 |


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
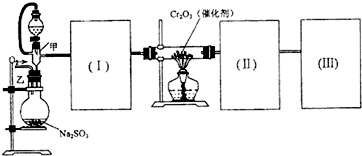
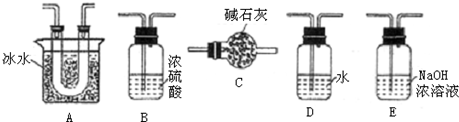
| Cl2O2 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
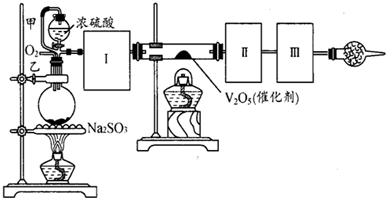
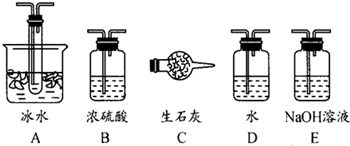
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cr2O3 |
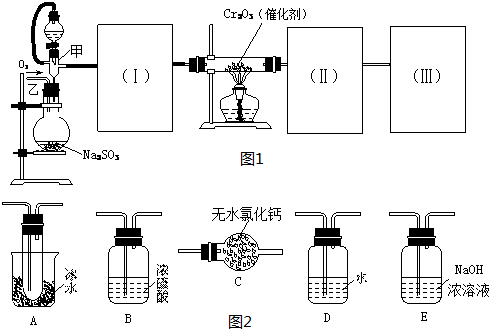
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应时,若温度过高,可有红棕色气体产生,写出反应的化学方程式:_____________________________________。
(2)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是____________,必须使用的仪器是__________________。
(3)本实验的产率为60%,则可制取溴乙烷____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com