
ǿ���ǿ���ϡ��Һ���к��ȿɱ�ʾΪ��
H+(aq)+OH-(aq)��H2O(1) ��H = -57.3kJ��mol
��֪��CH3COOH(aq)+NaOH(aq)��CH3COONa(aq)+H2O(1) ��H =- Q1kJ��mol
1/2 H2SO4(Ũ) + NaOH(aq) == 1/2Na2SO4(aq) +H2O(1) ��H =- Q2kJ��mol
HNO3(aq)+KOH(aq)��KNO3(aq)+H2O(1) ��H =- Q3kJ��mol
������Ӧ��Ϊ��Һ�еķ�Ӧ����Q1��Q2��Q3�ľ���ֵ��С�Ĺ�ϵΪ
A.Q1��Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪һ���¶��£����������ܵ���ʵ�������ݣ�
| ���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25 �� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
| ��ȫ����ʱ��pH��Χ | ��9.6 | ��6.4 | 3��4 |
�Ժ������ʵ�����CuSO4��FeSO4��Fe2(SO4)3�Ļ����Һ��˵��������ȷ����(����)
A����û����Һ�мӹ������ۣ��ܹ۲쵽��ɫ��������
B����û����Һ����μ���NaOH��Һ�����ȿ������ɫ����
C���û����Һ��c(SO ):[c(Cu2��)��c(Fe2��)��c(Fe3��)]>5:4
):[c(Cu2��)��c(Fe2��)��c(Fe3��)]>5:4
D����û����Һ�м���������ˮ������pH��3��4����ˣ��ܵõ�������CuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ǰһ����ɢϵ�������ص����һ�ַ�ɢϵ���۲쵽���������ȳ������������
A.�������������еμ����� B.ƫ��������Һ�м�����
C.�Ȼ�����Һ�еμ�����������Һ D.�Ȼ�����Һ�еμӰ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ��װ�ã���ʢ��ˮ���ձ��У���Ȧ����Ȧ����Ӵ�����һ����Ե��ϸ˿��ʹ֮ƽ�⡣С�ĵش��ձ��������AgNO3��Һ��Ƭ�̺�ɹ۲쵽��������(ָ�����Ľ���Ȧ)
 A����Ȧ����Ȧ����ҡ�ڲ��� B������ƽ��״̬����
A����Ȧ����Ȧ����ҡ�ڲ��� B������ƽ��״̬����
C����Ȧ������б D����Ȧ������б
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��Ԫ�����ڱ���A���е�����Ԫ�ء�����������˵��X�ķǽ����Ա�Yǿ����
A. Xԭ�ӵĵ��Ӳ�����Yԭ�ӵĵ��Ӳ�����
B. X���⻯��ķе��Y���⻯��ķе��
C. X����̬�⻯���Y����̬�⻯���ȶ�
D. Y�ĵ����ܽ�X��NaX����Һ���û�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾ���ձ��ж�ʢ��ϡ���
�� װ�ã�2����Fe�缫�ĵ缫��Ӧ��
��
װ�ã�3����Fe�缫�ĵ缫��Ӧ��
��
�� װ�ã�2��Sn��������Һ��pH ���������������С�����䡱��
�� �Ƚϣ�1������2������3����������ʴ�������ɿ쵽����˳���� �������š���
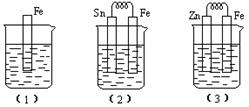
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
д����ȥ���������л��е�����(������Ϊ����)�ɲ�ȡ�ķ�����
(1)CO(CO2)��__________________________________________________________��
(2)CO2(CO)��__________________________________________________________��
(3)CO2(O2)��__________________________________________________________��
(4)CO2(SO2)��_________________________________________________________��
(5)CO2(HCl)��_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й���SiO2��CO2�������в���ȷ���� (����)
A�����ǹ��ۻ�����
B���������������������ǿ����Һ��Ӧ
C����������ˮ����ˮ��Ӧ������Ӧ����
D��SiO2�������ƹ��ά���ɱ��������˹�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�������̿�(ֻ��MnO2��MnO)��H2SO4(����)��FeS2�Ʊ�MnSO4��H2O����������(��֪�����е�FeS2��FeSO4��MnO2��MnO����ȫ��Ӧ)��

(1)��֪����ֻ��������Ӧ������������Ӧ��
MnO��H2SO4===MnSO4��H2O
FeS2��H2SO4===FeSO4��H2S����S��
��ɵ�������Ӧ�� MnO2��
MnO2�� FeSO4��
FeSO4�� ________===
________=== MnSO4��
MnSO4�� ________��
________�� ________
________
(2)����A��B�Ļ�ѧʽ�ֱ���___________________��
(3)��ҺX�е�������__________________��ʵ������Ũ����ҺYʱʹ�õIJ���������__________________��
(4)���õ��ij���A��������MnSO4��H2O�������ֱ�Ϊ96.0 g��321.1 g�����м����MnOΪ0.1 mol�������������̿���MnO2��MnO�����ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com