(2012?安徽)亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常1kg样品中含SO
2的质量计),某研究小组设计了如下两种实验流程:
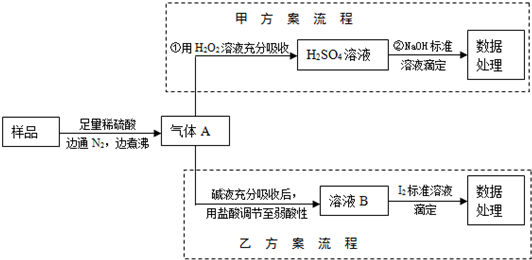
(1)气体A的主要成分是
SO2
SO2
,为防止煮沸时发生暴沸,必须先向烧瓶中加入
碎瓷片
碎瓷片
;通入N
2的目的是
将生成的SO2全部赶出(防止SO2在水溶液中被O2氧化)
将生成的SO2全部赶出(防止SO2在水溶液中被O2氧化)
.
(2)写出甲方案第①步反应的离子方程式:
SO2+H2O2=SO42-+2H+
SO2+H2O2=SO42-+2H+
.
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是
在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次
在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次
.
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果
无影响
无影响
(填“偏高”、“偏低”或“无影响”)
(5)若取样品wg,按乙方案测得消耗0.01000mol?L
-1I
2溶液VmL,则1kg样品中含SO
2的质量是
g(用含w、V的代数式表示).




 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案