
| 2×178.2 |
| 198 |
| 0.92 |
| 0.12×0.05 |
| 198×0.8 |
| 2 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,立即切下绿豆大小的钠,放入装满水的烧杯中 |
| B | 用自来水制取蒸馏水 | 在蒸馏烧瓶中加入适量自来水和几粒沸石,连接好装置,加热蒸馏烧瓶,用锥形瓶收集流出的液体 |
| C | 除去氯化镁溶液中混有的少量氯化铝 | 加入过量的氢氧化钠溶液,完全反应后过滤,将沉淀洗涤后加盐酸至恰好溶解 |
| D | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、从煤油中取用金属钠必需用镊子,不能用手触摸 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeBr2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全2Ba2++4OH-+Al3++2SO42-+NH4+═2BaSO4↓+Al(OH)3↓+NH3.H2O |
| C、向Mg(HCO3)2溶液中加入过量的 NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
| D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| B | 溴化钠溶液(NaI) | 氯水、四氯化碳 | 萃取、分液 |
| C | 苯(苯酚) | NaOH溶液 | 过滤 |
| D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
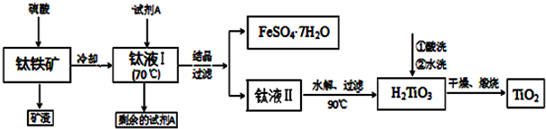
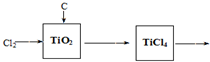
查看答案和解析>>
科目:高中化学 来源: 题型:
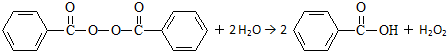
| A、并非在食品中添加化学物质都对人体有害 |
| B、过氧化苯甲酰能使面粉增白的原因是它与水反应生成的H2O2具有漂白性 |
| C、苯甲酸的同分异构体中,既属于醛又属于酚的物质有4种 |
| D、甲苯经两步取代反应和两步催化氧化反应可转化为苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、M的相对分子质量是180 |
| B、1 mol M最多能与5 mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1 mol M与足量NaHCO3反应能生成2 mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com