
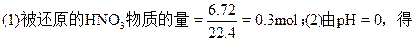
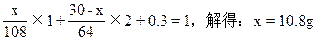
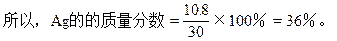


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.Fe3+和Cu2+ | B.Fe2+和Cu2+ |
| C.Fe2+和Fe3+ | D.只有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氧化铁可以由相关物质通过化合反应而制得 |
| B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI====FeI3+3H2O |
| D.铁元素位于周期表的第四周期第ⅧB族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe Cu Al Ag Mg |
| B.Al Cu Mg Ag Fe |
| C.Mg Cu Al Ag Fe |
| D.Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可表示为3YO3·3FeO·Fe2O3 | B.可表示为Y3O5·Fe3O4·Fe2O3 |
| C.其中钇、铁的化合价均为+3价 | D.其中钇、铁的化合价均有+2、+3价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com