
【题目】下列关于浓硝酸和浓硫酸的叙述中正确的是( )
A. 常温下不能用铝制容器贮存
B. 露置在空气中,容器内酸液的质量都增加
C. 露置在空气中,容器内酸液的浓度都减小
D. 常温下都能与铜剧烈反应
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
A.2H2(g)+O2(g)═2H2O(l)△H1???? 2H2(g)+O2(g)═2H2O(g)△H2
B.S(g)+O2(g)═SO2(g)△H1????? ??S(s)+O2(g)═SO2(g)△H2
C.C(s)+ ![]() O2(g)═CO(g)△H1??????? C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1??????? C(s)+O2(g)═CO2(g)△H2
D.H2(g)+Cl2(g)═2HCl(g)△H1 ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H2
Cl2(g)═HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目为
A. A+n+48+xB. A-n-24-xC. A-n+24-xD. A+n+24-x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
(1)实验I 制取氯酸钾和氯水利用如图所示的实验装置进行实验.
(i)盛放浓盐酸的实验仪器名称是 .
(ii)A中发生反应的化学方程式是 .
(iii)B中生成氯酸钾的离子反应方程式是
(iv)若对调B和C装置的位置,(填“能”或“不能”)提高B中氯酸钾的产率,原因是 .
(2)实验II 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定.
乙方案:与足量Zn反应,测量生成的H2体积.
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样.
a.量取试样20.00ml,用0.10molL﹣1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,则该次滴定所测的试样中盐酸浓度为;
b.重复滴定三次后获得实验结果.
②进行乙方案实验:装置如图所示(夹持器具已略去) .
.
(i)使Y形管中的残余清液与锌粒反应的正确操作是将转移到中,否则会造成实验结果偏低.
(ii)反应完毕,读取H2的体积,读数时应注意:a.冷却至室温b.c.视线与凹液面最低处相切.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 红磷、白磷属于同位素B. H2、D2属于同素异形体
C. 4019K、4020Ca互为同位素D. H、D、T互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( ) 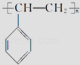
A.聚苯乙烯能使溴水褪色
B.聚苯乙烯是一种天然高分子化合物
C.聚苯乙烯可由苯乙烯通过化合反应制得
D.聚苯乙烯单体的分子式为C8H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,写出元素名称,并写出核外电子排布式.
(1)A元素原子核外M层电子数是L层电子数的一半: .
(2)B元素原子的最外层电子数是次外层电子数的1.5倍: .
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃: .
(4)D元素的次外层电子数是最外层电子数的 ![]() : .
: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的说法正确的是
A. 二氧化碳、二氧化硅、一氧化碳均为酸性氧化物
B. 雾、稀豆浆、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、稀硫酸均属于电解质
D. 分子中含有两个氢原子的酸不一定是二元酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com