
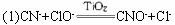
操作过程为:将浓缩后含CN-的污水(其中CN-浓度为0.05 mol·L-1)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡胶塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。试根据要求完成下列问题:
(1)甲中反应的离子方程式为:_______________________________________;乙中反应的离子方程式为:__________________________________________________。
(2)乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式:_______________________________________________________。
(3)丙中加入的除杂试剂是____________(填序号)。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
(4)丁在实验中的作用是______________________________________________。
(5)戊中盛有足量的石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率(填“>”“=”或“<”)____________80%。
![]()
2CNO-+3ClO-+2H+====N2↑+2CO2↑+3Cl-+H2O
(2)Cl-+ClO-+2H+====Cl2↑+H2O
(3)A
(4)除去混合气体中的Cl2
(5)>
解析:解答此类实验题,首先要明白实验原理,①CN-+ClO-![]() CNO-+Cl-,②CNO-+ClO-
CNO-+Cl-,②CNO-+ClO-![]() CO2↑+N2;③Ca(OH)2+CO2
CO2↑+N2;③Ca(OH)2+CO2![]() CaCO3↓。其次要弄清各装置的作用,甲装置发生反应①,乙装置发生反应②,戊装置发生反应③,丙装置吸收杂质气体HCl,丁装置除去Cl2。再认真分析产生误差的原因,由于反应产生的CO2有一部分滞留在装置乙、丙、丁、戊中,不会被石灰水完全吸收,因此CN-被处理的百分率大于80%。
CaCO3↓。其次要弄清各装置的作用,甲装置发生反应①,乙装置发生反应②,戊装置发生反应③,丙装置吸收杂质气体HCl,丁装置除去Cl2。再认真分析产生误差的原因,由于反应产生的CO2有一部分滞留在装置乙、丙、丁、戊中,不会被石灰水完全吸收,因此CN-被处理的百分率大于80%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
CN-+ClO-====CNO-+Cl-;2CNO-+3ClO-+2H+====N2↑+2CO2↑+H2O+Cl-。某研究性学习小组用图15-6装置进行模拟实验,以证明上述处理CN-污水的有效性,并测定CN-被处理的百分率,下述实验装置是通过测定CO2的量来确定CN-处理的效果。
试根据要求完成下列问题:

图15-6
(1)将浓缩后含有CN-的污水(其中CN-浓度为0.05 mol·L-1)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式:_____________________________________________________________。
②丙中加入的除杂试剂是__________。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
③丁装置在实验中的作用是_______________。
④戊中盛有足量石灰水,若实验后戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率为___________。
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出两点即可):________
_________________________________________________________。
(3)若有人想用测定氮气的量来确定CN-被处理的百分率,是否可行?如可行,还需要添加的仪器有________________________橡皮塞、导管及橡皮管。装置还可如何优化?
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
2CNO-+3ClO-+2 H+====N2↑+2CO2↑+3Cl-+H2O。某科研部门用图1-5-25所示装置进行模拟实验,以证明上述处理CN-污水方法的有效性,并测定CN-被处理的百分率,下述实验装置通过测定CO2的量来确定CN-的处理效果。
试根据要求完成下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.50 mol·L-1)20 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。乙装置中生成的气体除含有CO2、N2、HCl外,还有副反应生成的Cl2等物质,写出生成Cl2的副反应的离子方程式:_____________________________________________。
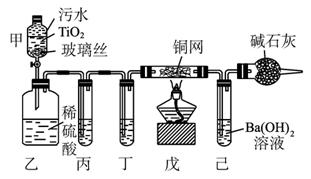
图1-5-25
(2)丙中加入的除杂试剂是_________,丁中的试剂是_________。
A.饱和碳酸氢钠溶液 B.饱和食盐水
C.浓硫酸 D.饱和碳酸钠溶液
(3)戊在实验中的作用是______________________________________________________
____________________________________________________________________。
(4)若己中盛有足量氢氧化钡,实验后己中共生成1.773 g沉淀,则该实验中CN-被处理的百分率为_________ (Ba的相对原子质量为137)。
(5)若己中盛有的氢氧化钡溶液为10 mL,要使CN-完全被氧化,氢氧化钡的物质的量浓度最低为_________ (保留1位小数)。
(6)上述实验中造成戊中碳酸钡质量测定值偏小的可能原因有(写出两点即可) ____________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 6.1 环境污染的化学防治练习卷(解析版) 题型:实验题
环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大。治理含CN-污水的方法之一是:在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2和H2O。其离子反应方程式为:2CN-+5ClO-+2H+===2CO2↑+N2↑+5Cl-+H2O,试根据要求回答下列问题:
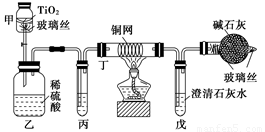
(1)将浓缩后含CN-的污水(其中CN-浓度为0.05 mol/L)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式: _______________________________________。
②丙中加入的除杂试剂是________(填字母代号)。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
③丁在实验中的作用是_______________________________________________________。
④戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率________(填“>”、“=”或“<”)80%。(不考虑CO2的溶解)
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出两点即可):________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com