
 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.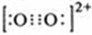 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA.分析 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则A是H、D是O元素,甲是H2O、乙是H2O2;
B是形成化合物种类最多的元素,为C元素;
C原子基态时2p原子轨道上有3个未成对的电子,则C是N元素;
E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同,则E是Ca元素;
I.(1)阴阳离子之间存在离子键,非金属元素之间易形成共价键,含有孤电子对和空轨道的原子之间易形成配位键;
Cu是29号元素,其原子核外有29个电子,Cu原子失去最外层1个电子生成Cu+,根据构造原理书写Cu+核外电子排布式;
(2)C2H2与HCN反应可得丙烯腈(H2C=CH-C≡N),HCN分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断HCN分子的构型;
丙烯腈分子中亚甲基C原子价层电子对个数是3、剩余两个C原子价层电子对个数是2,根据价层电子对互斥理论判断C原子杂化类型;
II.(3)CaC2中的C22-与O22+互为等电子体,等电子体原子个数相同、电子数相同、结构相似,据此书写O22+的电子式;一个O22+中含有2个π键;
(4)工业制C2H2的原料(CaC2、H2O)以及产物(C2H2)的沸点从高到低排序,离子晶体熔沸点高于分子晶体,含有氢键的熔沸点较高;
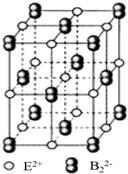
(5)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为0.387nm、0.387nm、0.637nm,CaC2晶体中,阳离子的配位数为4,距离最近的两个阳离子之间的距离=$\sqrt{2}$×$\frac{0.387}{2}$nm;
该晶胞中Ca2+个数=12×$\frac{1}{4}$+1=4、C22-个数=8×$\frac{1}{8}$+8×$\frac{1}{2}$=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则A是H、D是O元素,甲是H2O、乙是H2O2;
B是形成化合物种类最多的元素,为C元素;
C原子基态时2p原子轨道上有3个未成对的电子,则C是N元素;
E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同,则E是Ca元素;
I.(1)阴阳离子之间存在离子键,非金属元素之间易形成共价键,含有孤电子对和空轨道的原子之间易形成配位键,所以铜铵络离子和氯离子之间存在离子键、N-H原子之间存在共价键、Cu原子和N原子之间存在配位键,所以该物质中含有离子键、共价键和配位键;
Cu是29号元素,其原子核外有29个电子,Cu原子失去最外层1个电子生成Cu+,根据构造原理书写Cu+核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,
故答案为:离子键、共价键和配位键;1s22s22p63s23p63d10或[Ar]3d10;
(2)C2H2与HCN反应可得丙烯腈(H2C=CH-C≡N),HCN分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论知,HCN分子的构型为直线形,丙烯腈分子中亚甲基C原子价层电子对个数是3、剩余两个C原子价层电子对个数是2,根据价层电子对互斥理论判断C原子杂化类型为sp和sp2,
故答案为:直线形;sp和sp2;
II.(3)CaC2中的C22-与O22+互为等电子体,等电子体原子个数相同、电子数相同、结构相似,据此书写O22+的电子式为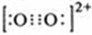 ;一个O22+中含有2个π键,则1mol该离子含有2NA个π键,
;一个O22+中含有2个π键,则1mol该离子含有2NA个π键,
故答案为: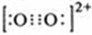 ;2NA;
;2NA;
(4)工业制C2H2的原料(CaC2、H2O)以及产物(C2H2)的沸点从高到低排序,离子晶体熔沸点高于分子晶体,含有氢键的熔沸点较高,水中含有氢键而乙炔中不含氢键,则熔沸点大小顺序是CaC2 H2O C2H2,
故答案为:CaC2 H2O C2H2;CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2;
(5)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为0.387nm、0.387nm、0.637nm,CaC2晶体中,阳离子的配位数为4,距离最近的两个阳离子之间的距离=$\sqrt{2}$×$\frac{0.387}{2}$nm=0.273nm;
该晶胞中Ca2+个数=12×$\frac{1}{4}$+1=4、C22-个数=8×$\frac{1}{8}$+8×$\frac{1}{2}$=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{64}{{N}_{A}}×4}{(0.387×0.387×0.673)×1{0}^{-21}}$g/cm3,
故答案为:4;0.273;$\frac{\frac{64}{{N}_{A}}×4}{(0.387×0.387×0.673)×1{0}^{-21}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体、熔沸点比较、原子核外电子排布等知识点,侧重考查学生分析计算能力,注意(5)中阳离子配位数是4而不是6,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去→加成→取代 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
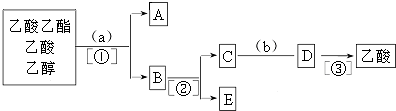
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
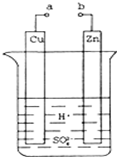 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
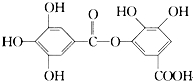
| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 在一定条件下,1 mol该物质最多能和4 mol Br2反应 | |
| C. | 它可以水解,水解产物为两种有机物 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
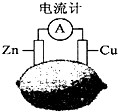
| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com