
表明反应________的化学方程式,叫做热化学方程式.热化学方程式不仅表明了化学反应中的________,也表明了化学反应中的________.
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| ||
| 高温高压 |
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源:新教材新学案 配合普通高中课程标淮实验教科书 化学② 必修 题型:013
|
二战期间丹麦科学家玻尔被迫离开德军占领的祖国,为了表明一定要返回祖国的决心,他把自己获得的金质诺贝尔奖章放在盛有王水的玻璃瓶中留了下来;反应的化学方程为: Au+HNO3+3HCl=AuCl3+NO↑+2H2O;战后玻尔从溶液中提取金,又重新铸成了奖章,下列方法中,你认为不能从溶有黄金的王水中提取金的是 | |
| [ ] | |
A. |
用铁置换 |
B. |
电解其水溶液 |
C. |
先蒸发水分后灼烧固体 |
D. |
过滤 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:填空题
目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)  N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
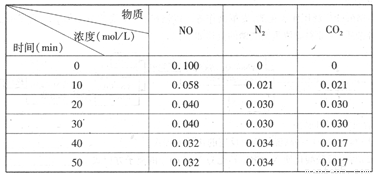
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO  N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)近年来,在超临界CO2(临界温度Tc = 304.3K;临界压力pc = 72.8×105Pa)中的反应引起广泛关注。该流体的密度在临界点附近很容易调制,可认为是一种替代有机溶剂的绿色溶剂,该溶剂早已用于萃取咖啡因。然而,利用超临界CO2的缺点之一是CO2必须压缩。
10-1 计算将CO2从1bar压缩到50bar所需的能量,其最终体积为50ml,温度为298K,设为理想气体。
10-2 实际气体用如下方程描述(近似的):
[p+a(n/V)2](V-nb) = nRT
对于CO2:a =3.59×105 Padm6mol-2 b = 0.0427dm3mol-1
分别计算在温度为305K和350K下为达到密度220gdm-3,330 gdm-3,440 gdm-3所需的压力。
10-3 超临界流体的性质,如二氧化碳的溶解能力和反应物的扩散性与液体的密度关系密切,上问的计算表明,在哪一区域――近临界点还是在较高压力或温度下更容易调制流体的密度?
10-4 在超临界二氧化碳中氧化醇类,如将苄醇氧化为苯甲醛,是一种超临界工艺,反应在催化选择性效率为95%的Pd/Al2O3催化剂作用下进行。
(1)写出主要反应过程的配平的反应式。
(2)除完全氧化外,进一步氧化时还发生哪些反应?
10-5 在另一超流体工艺合成有机碳酸酯和甲酰胺的例子中,二氧化碳既是溶剂又可作为反应物替代光气或一氧化碳。
(1)写出甲醇和二氧化碳反应得到碳酸二甲酯的配平的化学反应方程式,如以光气为反应物如何得到碳酸二甲酯?
(2)用适当的催化剂可用吗啉和二氧化碳合成甲酰基吗啉。该反应还需添加什么反应物?写出反应式;若用一氧化碳替代,反应式如何?
10-6 用绿色化学的观念给出用二氧化碳代替一氧化碳和光气的两个理由。与以CO或COCl2为反应物对比,再给出用CO2为反应物的1个主要障碍(除必须对二氧化碳进行压缩外)
注:吗啉的分子式为C4H9NO;结构式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com