
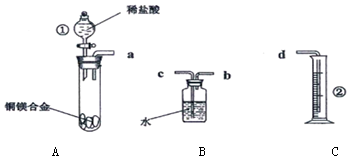
分析 (1)镁与盐酸反应生成氯化镁与氢气;
(2)根据装置图可知仪器名称;
(3)甲组同学利用重量法为思路,则残余的固体即为铜的质量,用铜的质量除以样品的质量即为铜的质量分数,乙组同学利用排水法测量气体体积为思路,根据氢气的体积V结合密度计算得氢气的质量,再根据氢气的质量计算出镁的质量,用样品的质量减去镁的质量即为铜的质量,用铜的质量除以样品的质量即为铜的质量分数,据此计算;
(4)a.读取量筒中水的体积时,未等装置中气体恢复至室温,则读得的氢气的体积偏大;
b.未考虑B、C装置间连接导管中残留的水,则测得的氢气的体积偏小;
c.未对反应后剩余的残余物进行洗涤,使得测得的铜的质量偏大;
d.用排水法测量氢气的体积,挥发出的HCl气体对实验没有影响;
解答 解:(1)镁与盐酸反应生成氯化镁与氢气,反应的化学方程式为Mg+2HCl=MgCl2+H2↑,
故答案为:Mg+2HCl=MgCl2+H2↑;
(2)根据装置图可知仪器①的名称为分液漏斗,②的名称为量筒,
故答案为:分液漏斗;
(3)甲组同学利用重量法为思路,则残余的固体即为铜的质量,所以铜的质量分数为$\frac{{m}_{2}}{{m}_{1}}$×100%,乙组同学利用排水法测量气体体积为思路,根据氢气的体积V结合密度计算得氢气的质量为ρV×10-3g,再根据Mg+2HCl=MgCl2+H2↑,可知参加反应的镁的质量为$\frac{24}{2}$×ρV×10-3g,样品中铜的质量为m1g-$\frac{24}{2}$×ρV×10-3g,所以铜的质量分数为$\frac{{m}_{1}g-\frac{24}{2}×ρV×1{0}^{-3}}{{m}_{1}g}$×100%=(1-$\frac{3ρV}{250{m}_{1}}$)×100%,
故答案为:$\frac{{m}_{2}}{{m}_{1}}$; (1-$\frac{3ρV}{250{m}_{1}}$)×100%;
(4)a.读取量筒中水的体积时,未等装置中气体恢复至室温,则读得的氢气的体积偏大,导致铜的质量分数小于理论值;
b.未考虑B、C装置间连接导管中残留的水,则测得的氢气的体积偏小,导致铜的质量分数大于理论值;
c.未对反应后剩余的残余物进行洗涤,使得测得的铜的质量偏大,导致铜的质量分数大于理论值;
d.用排水法测量氢气的体积,挥发出的HCl气体对实验没有影响;
故答案为:bc;a.
点评 本题主要考查实验基本操作和样品能成成份的测定的实验设计,题目难度中等,注意实验原理的分析,灵活运用实验基本操作和化学计算的相关知识.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
| 第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
| 第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定氯水的pH,用滴管吸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com