
【题目】钠-CO2电池的工作原理如图所示,吸收的CO2转化为Na2CO3固体和碳,沉积在多壁碳纳米管(MWCNT)电极表面,下列说法不正确的是( )
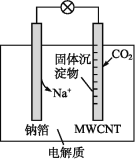
A.负极反应式为Na-e-=Na+
B.多壁碳纳米管(MWCNT)作电池的正极
C.可以用乙醇代替四甘醇二甲醚作有机溶剂
D.电池总反应式为4Na+3CO2=2Na2CO3+C
【答案】C
【解析】
由装置图可知,钠为原电池负极,失电子发生氧化反应,电极反应为:Na-e-=Na+,多壁碳纳米管为正极,CO2 转化为 Na2CO3 固体和碳,沉积在多壁碳纳米管(MWCNT)电极表面,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C,结合原电池原理分析解答。
A.负极反应为钠失电子发生的氧化反应,电极反应为:Na-e-═Na+,故A正确;
B.根据分析可知,多壁碳纳米管(MWCNT)做电池的正极,故B正确;
C.钠和乙醇发生反应生成氢气,不可以用乙醇代替四甘醇二甲醚做有机溶剂,故C错误;
D.根据分析,放电时电池总反应即钠与二氧化碳反应生成碳酸钠和碳,总反应是4Na+3CO2=2Na2CO3+C,故D正确;
故选C。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
A. 升高温度,K增大B. 减小压强,n(CO2)增大
C. 充入一定量的氮气,n(H2)不变D. 更换高效催化剂,CO的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A. CH2===CH2+H2![]() CH3CH3B.
CH3CH3B. ![]()
C. CH3CH2OH+3O2![]() 2CO2+3H2OD. CH3COOH+CH3CH2OH
2CO2+3H2OD. CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是
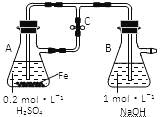
A. 用上图装置可以制备沉淀Fe(OH)2
B. 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C. FeCl3溶液中滴加KSCN溶液会生成红色沉淀
D. 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
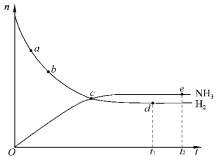
A. 点a的正反应速率比点b的小
B. 点c处正反应速率和逆反应速率相等
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)相同
D. 在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A. c1:c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0 mol/L<c1 <0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
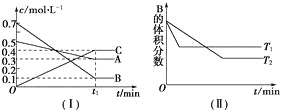
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________________________,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时,A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
④ 若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“正向”、“ 逆向”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
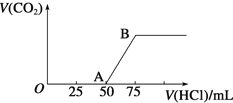
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是 ( )
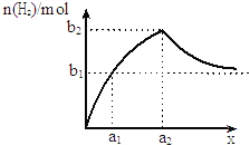
A.a1=![]() B.a2=1C.b1=
B.a2=1C.b1= ![]() D.b2=
D.b2=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com