
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是
 :
:
A.a线代表的是PbCO3
B.T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5。
C.T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
D.T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:选择题
常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq)离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三下第四次模拟理综化学试卷(解析版) 题型:实验题
中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。

(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式: 。
(2)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为 。
②陶瓷多孔球泡的作用是 。
(3)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00ml标准液时达到滴定终点,反应原理涉及到的方程式为:
3ClO-+I-=3Cl-+ IO3- IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为 ,达到滴定终点的标志是 。
②该漂白粉中有效成分的质量分数为 。
(4)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为 ,该现象能够证明氯气有氧化性。甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
下列坐标图均涉及到平衡原理,其中相关表述正确的是( )

A.图②表示2SO2(g)+O2(g) 2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
B.图③表示反应2NH3(g) 3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
C.图④表示AgCl(s) Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
D.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:简答题
[化学——选修3:物质结构与性质] X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列。回答下列问题(若需表示具体元素必须用相应的元素符号):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_____________(用元素符号表示),Y的最简单气态氢化物在水中的溶解度远大于X的最简单气态氢化物,主要原因是____________。
(2)R元素基态原子的电子排布式为_______。Z、M形成化合物M2Z2的电子式为_________。
(3)X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是_________,提供孤对电子的是__________________(填化学式)。
(4)已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石。该化合物的化学式为_____,其晶体类型为______,晶体中X、Y两种元素原子的杂化方式均为___________。
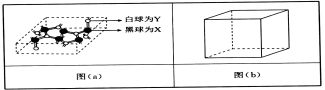
(5)在图(b)中标出R晶体中R原子的位置,该晶体中R原子直径为a pm,R的相对原子质量为M,阿伏加德罗常数为NA,该晶胞密度表达式为___________g·cm-3(用a,M,NA表示)。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA
B.常温下,100 mL 1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
C.将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
D.1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
查看答案和解析>>
科目:高中化学 来源:2016届福建师大附中高三下学期模拟考试理综化学试卷(解析版) 题型:实验题
硝基苯是重要的化工原料,用途广泛。制备反应如下:



组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一平行班下期中化学试卷(解析版) 题型:选择题
如下图所示:△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )

A.石墨转化为金刚石需吸热
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.石墨和金刚石是同分异构体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列叙述能说明反应2A(g)+B(g)
 2C(g)已达平衡状态的有( )
2C(g)已达平衡状态的有( )
①A、B、C的百分含量相等;
②单位时间,消耗a mol B,同时生成2a mol C;
③单位时间,消耗a mol A,同时生成0.5a mol B;
④外界条件不变时,物质总质量不随时间改变;
⑤外界条件不变时,气体总分子数不再变化;
⑥A、B、C分子数之比为2:1:2.
A.除④外 B.除②⑥外 C.②④⑤ D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com