
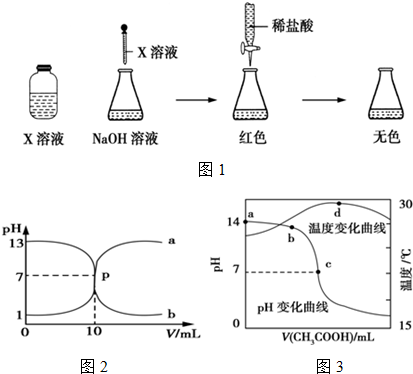
分析 (1)①锥形瓶中氢氧化钠溶液显示红色,故加入的是酚酞;
②根据图中起始时溶液的pH判断盐酸的浓度;盐酸滴定氢氧化钠时锥形瓶中为氢氧化钠,pH变化由大到小;
(2)①恰好完全反应生成醋酸钠,醋酸钠水解显碱性;
②甲基橙试液变红说明溶液显酸性;
③A.氢氧化钠溶液中氢离子全部由水电离,根据Kw计算;
B.b点溶液显碱性性,溶质为:NaOH和CH3COONa;
C.根据电荷守恒分析;
D.酸碱恰好反应放热最多,醋酸过量时发生热量传递.
解答 解:(1)①由图1可知,锥形瓶中氢氧化钠溶液显示红色,在碱性溶液中显红色的指示剂为酚酞,则X是酚酞,
故答案为:酚酞;
②由图中起始时溶液的pH=1可知,溶液中氢离子浓度为0.1000mol/L,则盐酸的浓度为0.1000 mol•L-1;盐酸滴定氢氧化钠时锥形瓶中为氢氧化钠,pH变化由大到小,则b曲线是盐酸滴定NaOH溶液;
故答案为:0.1000 mol•L-1;盐酸滴定NaOH溶液;
(2)①醋酸和氢氧化钠发生中和反应后,溶液中只含有 OH-、H+、Na+、CH3COO- 4种离子,当醋酸与氢氧化钠恰好完全反应生成醋酸钠,醋酸钠水解显碱性;
故答案为:碱;
②甲基橙试液变红说明溶液显酸性,由于溶液中只含有 OH-、H+、Na+、CH3COO- 4种离子,则溶液的溶质为CH3COOH和CH3COONa;
故答案为:CH3COOH和CH3COONa;
③A.a点为没有开始滴定的氢氧化钠溶液,在氢氧化钠溶液中氢离子全部由水电离,则(H+)=$\frac{1{0}^{-14}}{1}$=1×10-14 mol•L-1,故A正确;
B.b点溶液显碱性,溶质为:NaOH和CH3COONa,则c(CH3COO-)+c(CH3COOH)<c(Na+),故B正确;
C.在c点溶液中存在电荷守恒为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),pH=7,则c(OH-)=c(H+),所以c(CH3COO-)=c(Na+),故C正确;
D.酸碱恰好反应放热最多,则当醋酸过量时,不再反应放热,由于醋酸的温度低于原混合溶液的温度,则继续滴加醋酸时,溶液的热量会部分传递给后来滴加的醋酸溶液,导致温度会降低,故D错误;
故答案为:ABC.
点评 本题考查了中和滴定实验、酸碱混合的定性判断和计算,题目难度中等,本题注意实验方法的设计与评价,考查同学的评价能力和实验基本操作能力.


科目:高中化学 来源: 题型:选择题
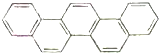 第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )
第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )| A. | 该有机物的一氯代物共有四种 | |
| B. | 该有机物是只含非极性键的非极性分子 | |
| C. | 该有机物属于芳香族化合物,是苯的同系物 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出各步反应的化学方程式.
,写出各步反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①②的名称分别为溶解、过滤 | |
| B. | 步骤③中使用的化学仪器有酒精灯、三角架、泥三角、坩埚、玻璃棒 | |
| C. | 步骤①②③中都使用了玻璃棒,且三个操作中玻璃棒的作用不完全相同 | |
| D. | 步骤④的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com