
A��B��C��Ϊ��ѧ��ѧ�����ĵ��ʣ�����һ���ǽ�����ͨ��״���£�AΪ���壬BΪ����ɫ���壬CΪ���壬�����Ϊ�����X��һ�ֳ��õľ��лӷ��Ե�����ǿ�ᣬEΪ��ɫ���壬HΪ��ɫҺ�壬����֮���ת����ϵ��ͼ������ijЩ��Ӧ�����Ͳ�������ȥ����
 |
��1��д����A�Ļ�ѧʽ ��F�Ļ�ѧʽ ��
��2���ڷ�Ӧ�١����У�������������ԭ��Ӧ���� ������ţ���
��3����ɣ�E��X��Ӧ�����ӷ���ʽ�� ��
��4�����H��ij�ֻ����������C�Ļ�ѧ����ʽ ��ÿ����0.15molC����ת�� mol��
��5��B�����������������а��̼���һ�����嵥�ʲ������÷�Ӧ�Ļ�ѧ����ʽΪ��
��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
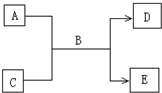 ��2009?�ϳ�ģ�⣩A��B��C��D��E��Ϊ��ѧ��ѧ�����Ĵ����BΪ��Ȼ���к�������Һ�壬����֮�������µķ�Ӧ��ϵ��
��2009?�ϳ�ģ�⣩A��B��C��D��E��Ϊ��ѧ��ѧ�����Ĵ����BΪ��Ȼ���к�������Һ�壬����֮�������µķ�Ӧ��ϵ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
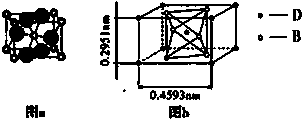
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
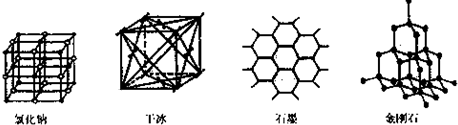
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ�����и�����ѧ�ڻ������Ի�ѧ�Ծ��������棩 ���ͣ������
��֪A��B��C��D����ѧ��ѧ�ij������ʣ�������һ��������������ת
����ϵ��
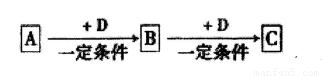
��1)��AΪ��ʹʪ��ĺ�ɫʯ����ֽ���������壬CΪ����ɫ���塣��A�Ŀռ乹��Ϊ ��Aת��ΪB��Ӧ�Ļ�ѧ����ʽΪ ��
(2)��A��B��C��Ϊ�����AΪש��ɫ���壬��A�н���Ԫ��Ϊ+1�ۣ�D��һ�ֺ�ɫ��̬�ǽ������ʣ���A�Ļ�ѧʽΪ ��B�ĵ���ʽΪ ��
(3)��DΪ�ȼҵ����Ҫ��Ʒ��BΪ���г�����һ�־������Ե����ʣ���C��Һ�г�����������ڵ������ӵĻ�ѧʽΪ ���ȼҵ�������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com