

分析 乙烯水化生成乙醇,B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成乙酸,C为CH3COOH,乙烯与溴水反应生成1,2-二溴乙烷,其水解生成乙二醇,乙二醇与乙酸发生酯化反应生成F,据此分析.
解答 解:乙烯水化生成乙醇,B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成乙酸,C为CH3COOH,乙烯与溴水反应生成1,2-二溴乙烷,其水解生成乙二醇,乙二醇与乙酸发生酯化反应生成F,
(1)乙醇被酸性高锰酸钾氧化生成乙酸,C为CH3COOH,故答案为:氧化反应;
(2)乙烯水化生成乙醇,B为CH3CH2OH,乙烯与溴水反应生成1,2-二溴乙烷,溴水褪色,故答案为:CH3CH2OH;溴水褪色;
(3)乙二醇与乙酸发生酯化反应生成F,反应方程式为2CH3COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
故答案为:2CH3COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O;
(4)B中含有羟基,C中含有羧基,可以用NaHCO3溶液鉴别,羧基遇NaHCO3溶液有气体生成,故答案为:NaHCO3溶液;
(5)F的分子式为C6H10O4,其同分异构体中含有2个-COOH,还有4个C原子,可以是HOOCCH2CH2CH2CH2COOH,CH3CH(COOH)CH2CH2COOH,CH3CH2CH(COOH)CH2COOH,
CH3CH2CH2CHCOOHCOOH,HOOCCHCOOHCHCH3CH3,HOOCCH2CCOOHCH3CH3,HOOCCH2CHCCH3CH2COOH,HOOCCCH3CH3CH2COOH,CH3CH2C(COOH)2CH3,
CH3CHCOOHCHCH3COOH,CH2COOHCH2CHCH3COOH,CH3CH2CHCH2COOHCOOH共12种,故答案为:12.
点评 本题考查有机物的结构与性质,题目难度中等,注意把握有机物的官能团的结构和性质,为解答该题的关键,易错点为同分异构体的判断,注意判断方法.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
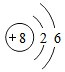 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
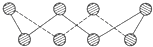 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO、O2、NO2的分子数目之比为2:1:2 | |
| B. | 反应混合物中各组成物质的浓度相等 | |
| C. | 混合气体的颜色不再发生变化 | |
| D. | 生成2molNO同时生成1molO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com