
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。

填写下列空白:
(1)写出化学式:A________,B_________,D_________E_______。
(2)以上反应中不属于氧化还原反应的有______________(填序号)。
(3)写出反应②④⑥的化学方程式:
②_______________________________。
④_______________________________。
⑥_______________________________。
(4)写出反应⑤的离子方程式:_____________________,写出铝粉和C溶液反应的离子方程式:___________________
科目:高中化学 来源:2015-2016学年辽宁省高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA
B.在常温常压下,11.2 升氯气含有的分子数为0.5NA
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.1 molFe与足量的Cl2反应转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上12月月考化学试卷(解析版) 题型:选择题
在生产、生活中为增大反应速率而采取的措施合理的是
A.食物放在冰箱中
B.塑料制品中添加抑制剂
C.在糕点包装内放置小包除氧剂
D.燃煤发电时用煤粉代替煤块
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
用惰性电极电解下列物质的水溶液时,在阳极上不生成O2的是( )
A.NaOH B.H2SO4 C.ZnCl2 D.Na2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二上学期第三次月考化学试卷(解析版) 题型:选择题
含有一个碳碳三键的炔烃,与氢气充分加成后的产物的结构简式为:
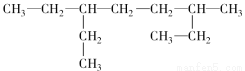 ,此炔烃可能的结构有( )
,此炔烃可能的结构有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省衡水市高一上第四次月考化学试卷(解析版) 题型:选择题
加入适量的H2SO4溶液,可使下列离子在溶液中的数目显著减少的是
A.Cl- B.NO3- C.Na+ D.CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高二上12月月考化学试卷(解析版) 题型:填空题
空气污染监测仪是根据SO 2 与Br 2 的定量反应测定空气中SO 2 的含量:SO 2 +Br 2 + 2H 2 O==H 2 SO 4 +2HBr,上述反应的溴,来自一个装满酸性KBr溶液的电解槽阳极上的氧化反应。电解槽的阴、阳极室是隔开的。当测空气中SO 2 的含量时,空气(经过除尘)以1.5×10 - 4 m 3·min - 1 的流速进入电解槽的阳极室,电流计显示每秒通过的电子是8.56×10 - 1 1mol时,此条件下能保持溴浓度恒定,并恰与SO 2 完全反应(设被测空气中不含与溴反应的物质)。
(1)写出监测过程中主要发生的化学反应方程式;_______________________。
(2)计算空气中SO 2 的含量(g·m - 3 空气)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列关于钠的叙述正确的是
A.钠在空气中露置会立刻被空气氧化成过氧化钠
B.钠单质具有强还原性,可将铜从其盐溶液中置换出来
C.钠与钠离子都具有强的还原性
D.钠与稀盐酸反应的实质是与氢离子的反应
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上1月阶段测理综化学试卷(解析版) 题型:填空题
矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0(M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是___________;
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.上述反应可实现多次储存和释放氢气
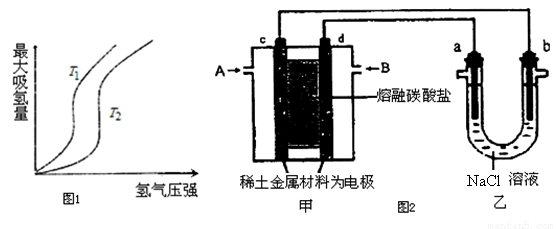
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
①工作过程中,甲装置中d电极上的电极反应式是________________;乙装置中电极a为_______极(填电极名称)。
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=__________。(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式________________;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g) 2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
①该反应的平衡常数表达式为:K=______________;
②能判断该反应是否达到化学平衡状态的依据是____________
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2): c(H2): c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的___________
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气
d、增加H2的浓度 e、充入He,使体系总压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com