
| A. | 配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质 | |
| B. | 滴定前对碱式滴定管仰视读数,滴定后又俯视 | |
| C. | 滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液 |
分析 分析不当操作对消耗标准液体积的影响,依据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$进行误差分析,凡是使V(标准)偏小的操作,所测浓度偏小,反之所测浓度偏高,据此解答.
解答 解:A.配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质,导致配制的标准液含有氢氧根离子浓度降低,滴定过程中消耗氢氧化钠溶液体积偏高,溶液浓度偏高,故A不选;
B.滴定前对碱式滴定管仰视读数,滴定后又俯视,导致读取的标准液体积偏小,溶液浓度偏低,故B选;
C.滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,导致读取的标准液体积偏大,溶液浓度偏高,故C不选;
D.碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液,导致标准液被稀释,消耗的标准液体积偏大,溶液浓度偏高,故D不选;
故选B.
点评 本题考查了酸碱中和滴定,侧重考查中和滴定误差分析,题目难度不大,准确判断错误操作对标准液体积的影响是解题关键,题目难度中等.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量始终小于92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| D. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
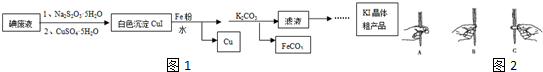
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
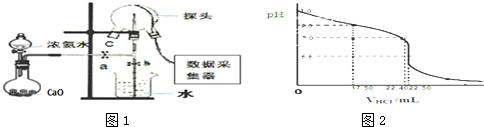
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
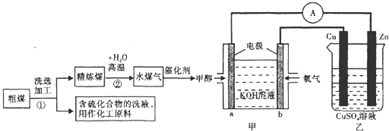
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
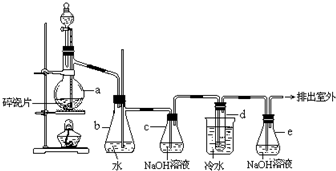
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯→乙二醇:CH2═CH2$\stackrel{加成}{→}$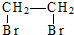 $\stackrel{取代}{→}$ $\stackrel{取代}{→}$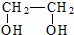 | |
| B. | 溴乙烷→乙醇:CH3CH2Br$\stackrel{消去}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷→1,3-丁二烯:CH3CH2CH2CH2Br$\stackrel{消去}{→}$CH3CH2CH=CH2$\stackrel{加成}{→}$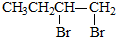 $\stackrel{消去}{→}$CH2═CH-CH═CH2 $\stackrel{消去}{→}$CH2═CH-CH═CH2 | |
| D. | 乙烯→乙炔:CH2═CH2$\stackrel{加成}{→}$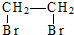 $\stackrel{消去}{→}$CH≡CH $\stackrel{消去}{→}$CH≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com