
分析 该温度下水的离子积为Kw=1×10-12,酸和碱混合,若所得混合液的pH=2,则酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$计算,列式计算pH.可计算体积比.
解答 解:该温度下水的离子积为Kw=1×10-12,将pH=11的苛性钠中氢氧根离子浓度为:c(OH-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-11}}$mol/L=0.1mol/L,pH=1的稀硫酸中氢离子浓度为0.1mol/L,
pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),
整理可得:V1:V2=9:11,
故答案为:9:11.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的计算方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
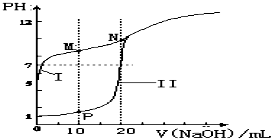 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是一种抗氧化药物,存在如图所示的转化关系.
是一种抗氧化药物,存在如图所示的转化关系.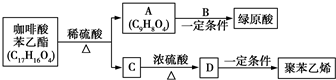
 .
.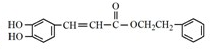 .
. (任写1个).
(任写1个).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
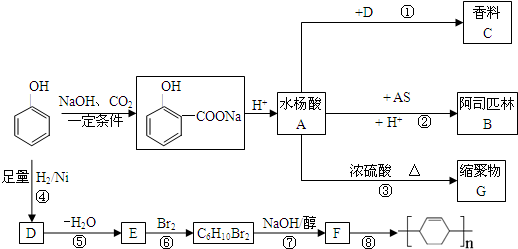
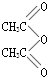 ,
, .
.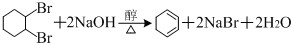 .
.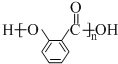 .
.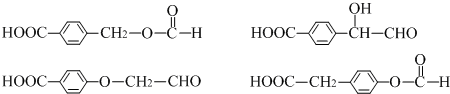 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
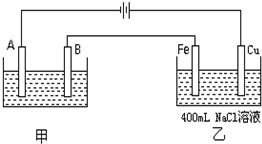 如图为相互串联的甲、乙两个电解池.试回答:
如图为相互串联的甲、乙两个电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaHCO3的热稳定性好 | |
| B. | 如图所示转化涉及的反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com