
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
分析 两种气态烃组成的混合气体0.2mol,完全燃烧生成0.3ml CO2和7.2g水,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,结合C、H原子守恒确定烃的分子式,以此来解答.
解答 解:两种气态烃组成的混合气体0.2mol,完全燃烧生成0.3ml CO2和7.2g水,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,
平均分子组成中H原子数目为$\frac{0.4mol×2}{0.2mol}$=4,
平均分子组成中C原子数目为$\frac{0.3mol}{0.2mol}$=1.5,
故该混合烃的平均分子式为C1.5H4,
根据C原子可知,该烃一定含有CH4,另一种烃含有4个H原子,可能为乙烯、丙炔等,只有A符合,
故选A.
点评 本题考查有机物分子式的确定,为高频考点,把握平均组成及原子守恒法为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
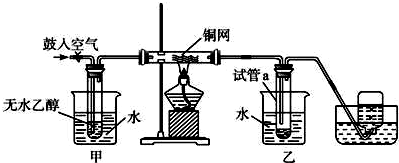
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
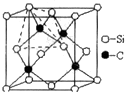 碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:
碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
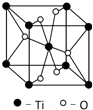 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
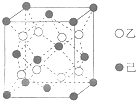 乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.
乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.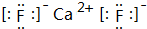 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点和N点对应的溶液均呈中性 | |
| B. | T1℃时,P点对应溶液中,水电离出来的c(H+)可能为10-4mol•K-1或10-10mol•L-1 | |
| C. | T2℃时,pH=11的NaOH溶液与pH=1的稀H2SO4等体积混合,所得溶液的pH=6 | |
| D. | 向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如图所示某有机物,根据该有机物的结构回答:
有如图所示某有机物,根据该有机物的结构回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
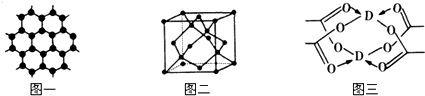
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com