
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| C. | 4.6g Na与足量O2反应后的产物中含离子数目为0.3NA | |
| D. | 标准状况下,2.24L Cl2通入足量H2O反应转移的电子数为0.1NA |
分析 A.依据n=$\frac{m}{M}$计算物质的量,结合有机物C2H6O存在同分异构体分析;
B.pH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L;
C.根据n=$\frac{m}{M}$,并结合原子守恒来计算;
D.氯气与水反应为可逆反应.
解答 解:A.依据n=$\frac{m}{M}$计算物质的量=$\frac{46g}{46g/mol}$=1mol,有机物C2H6O存在同分异构体,若为乙醇含有极性键的数目一定为7NA,若为甲醚含有极性键的数目一定为8NA,故A错误;
B.pH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L,故1L溶液中氢氧根的物质的量为0.01mol,个数为0.01NA个,故B错误;
C.钠的物质的量n=$\frac{m}{M}$=0.2mol,故生成的Na+离子的数目为0.2NA,0.1molO2-,共含离子数目为0.3NA,故C正确;
D.氯气与水反应为可逆反应,不能完全进行到底,所以标准状况下,2.24L Cl2通入足量H2O反应转移的电子数小于0.1NA,故D错误;
故选;C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意乙醇的结构、可逆反应不能进行到底的特点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | NH4NO3晶体中含共价键,是共价化合物 | |
| C. | H2O2、N2H4分子中只含有极性共价键 | |
| D. | 某化合物熔融状态能导电,可以证明该化合物内一定存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Z的最高价氧化物对应的水化物一定能溶于X的最高价氧化物对应的水化物 | |
| C. | X、W的简单气态氢化物都一定易溶于水 | |
| D. | Y的最高价氧化物对应的水化物的碱性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
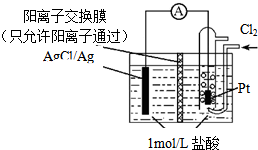
| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 用KCl溶液代替盐酸,则电池总反应不改变 | |
| D. | 当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g 金刚石中含有的六元碳环数为NA | |
| B. | 1L1mol/L 的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g 石墨和 C60的混合物中质子总数为6NA | |
| D. | 反应 KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 40℃时,在氨水体系中不断通入CO2,随着CO2的通入,$\frac{c(OHˉ)}{c(NH3•H2O)}$不断增大 | |
| C. | 室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯盐酸、空气、硫酸、干冰 | B. | 蒸馏水、氨水、氯化钠、二氧化硫 | ||
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 生石灰、漂白粉、氯化铜、碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
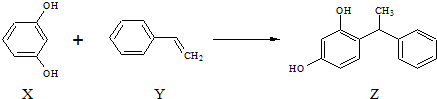
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z 均能使溴水褪色,但是原理不完全相同 | |
| D. | 该反应的反应类型为取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com