
【题目】在溶液中能共存,加入H+能放出气体的是
A.Ag+ 、H+、NO3-、Cl- B.Ca2+、NO3-、HCO3-、Cl-
C.K+、H+、Cl-、SO42- D.Ca2+、Cl-、SO42-、CO32-
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】准确称取Ag2O和Ag2O2的固体混合物2.588g,在一定条件下完全分解为Ag和O2,得到224.0mLO2(在标准状况下)。计算Ag2O和Ag2O2的物质的量。(写出必要过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式如图,关于该有机物,下列叙述不正确的是

A.能使酸性KMnO4溶液、溴水褪色,原理相同
B.1 mol 该有机物能与H2发生反应,消耗H2 4 mol
C.一定条件下,能发生加聚反应
D.该有机物苯环上的一个H被取代,有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有NH4+、Mg2+、Fe2+、Al3+和SO42﹣五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
A.4种
B.3种
C.2种
D.1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用浓硫酸和乙醇反应来制取乙烯,常因温度过高而生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫,试回答下列问题。

(l)图中①、②、③、④装置可盛放的试剂分别是:
①_______,②_______,③_______,④_______.(将下列有关试剂的序号填到横线上)
A.品红溶液 B. NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是_________________。
(3)说明含有乙烯的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,用0.1000mol/LCH3COOH溶液滴定NaOH溶液,当达到滴定终点时溶液的PH 7(填“>”、“<”或“=”),溶液中各离子浓度从大到小的顺序为 ;为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是 (填序号)
A、石蕊 B、甲基橙 C、酚酞 D、甲基橙或酚酞
(2)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液C(H+)/C(OH-)=_______
(3)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_______
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则C1/C2=________。
(5)已知H2A的电离方程式为:H2A=H++HA-;HA-![]() H++A2-。试判断H2A是 电解质(填“强”“弱”)。
H++A2-。试判断H2A是 电解质(填“强”“弱”)。
(6)PH相等的盐酸和醋酸各100ml,分别与过量的Zn反应,相同条件下生成H2的体积V(盐酸) V(醋酸)(填>;=;<)
(7)已知CH3COO-+H+![]() CH3COOH现要使平衡向右移动且氢离子浓度增大,应采取的措施是
CH3COOH现要使平衡向右移动且氢离子浓度增大,应采取的措施是
A.加NaOH B.加盐酸 C.加水 D.升高温度
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是
(8)向盛有0.1mol/LAgNO3溶液的试管中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成;再向其中滴加0.1mol/LKI溶液,白色沉淀变为黄色沉淀;再向其中滴加0.1mol/LNa2S溶液,黄色沉淀又变为黑色沉淀,由上述实验现象可以得出①AgCl ②AgI ③Ag2S的溶解度由大到小的顺序为 (用序号填空)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计了如下装置进行试验探究,请回答下列问题:
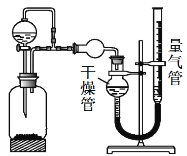
(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处水平,还应注意 。考虑到分液漏斗滴入瓶中液体的体积(其它操作都正确),则该装置测得气体的体积将 (填“偏大”、“偏小”或“无影响”)。
(2)若在瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀。
①通过分液漏斗向瓶中加入的试剂可选用下列 (填序号)
a.NaOH溶液 B.C2H5OH c.NaCl溶液 D.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是 。
(3)若瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度。你认为此方法是否可行 (填“可行”或“不可行”),若填“不可行”请说明原因 。
(4)为探究MnO2在H2O2制取O2过程中的作用,分别将等量 H2O2加入到瓶中,进行2次实验(气体体积在同一状况下测定):
序号 | 瓶中的物质 | 分液漏斗的物质 | 测得气体体积 |
实验1 | 足量MnO2 | 20mL H2O2 | V1 |
实验2 | 稀硫酸和足量MnO2 | 20mL H2O2 | V1<V2<2V1 |
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为 。
(5)若瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
Ⅰ | 1.0 g | 10.00 mL | 346.30 mL |
Ⅱ | 1.0 g | 10.00 mL | 335.50 mL |
Ⅲ | 1.0g | 10.00 mL | 346.00 mL |
Ⅳ | 1.0 g | 10.00 mL | 345.70 mL |
则镁铝合金中镁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是
A. pH=7的溶液
B. c(H+)=c(OH-)=10-6 mol·L-1的溶液
C. c(H+)水=c(OH-)水的溶液
D. 酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com