
(14分 )A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,B的产量是衡量一个国家石油化工发展水平的标志,他们之间并能进行如图所示的相互转化。

(1)写出A的结构简式 ,F中所含决定化学性质的原子团的名称为
(2)下列反应的化学方程式并注明反应类型
反应①: ,反应类型
反应②: ,反应类型
反应③: ,反应类型
反应④: ,反应类型
(14分)(1)C2H5OH 或 CH3CH2OH 羧基
(2)①2CH3CH2OH + 2Na →2CH3CH2ONa + H2↑ 取代反应
②CH2=CH2+H2O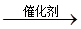 CH3CH2OH,加成反应
CH3CH2OH,加成反应
③CH3COOH + CH3CH2OH CH3COOCH2CH3
+ H2O 酯化反应或取代反应
CH3COOCH2CH3
+ H2O 酯化反应或取代反应
④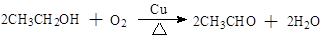 ,氧化反应
,氧化反应
【解析】B的产量是衡量一个国家石油化工发展水平的标志,则B是乙烯。乙烯含有碳碳双键,能和水发生加成反应,生成乙醇,A是乙醇。乙醇含有羟基,能和钠反应生成氢气和乙醇钠。也能和乙酸发生酯化反应生成乙酸乙酯,即C是乙酸乙酯,乙酸乙酯水解即生成乙酸。乙醇能发生催化氧化生成乙醛,即D是乙醛,乙醛再氧化生成乙酸,即F是乙酸,含有的官能团是羧基。


科目:高中化学 来源: 题型:
(14分)如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
(1)要将C装置接入B和D之间,正确的接法是:a→ → →d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为______________________。
为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_____________________________________________。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2 产生,此时B中的现象是 ,B的作用是______________________。
(4)用量筒量取20 mL E中溶液,倒入已检查完的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是 (填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是 (填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由______________________________,并在方框中画出改进后的装置图。
查看答案和解析>>
科目:高中化学 来源: 题型:
(本题14分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l—2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Fe<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点。选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
| 选用试剂(填序号) | 实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)结论
氧化性:Fe<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(5)实验后的思考
在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011届广东省中山市杨仙逸中学高三上学期联考化学卷 题型:实验题
(共14分)A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
填写下列空白:
(1)(3分)物质A是 ,B是 ,B的离子结构示意图为 。
(2)(5分)写出化合物E的电子式: ,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示): 。D溶液可以用来止血,请简单说明其止血原理是: 。
(3)(4分)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是 ,漂白粉常用于自来水的杀菌消毒,原因是(写出反应的化学方程式,并加以适当的文字
说明): 。
(4)(2分)F中加入NaOH溶液,并在空气中放置由白色变为灰绿色最后变成红褐色沉淀的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省汶上一中高一下学期期中考试化学试卷(带解析) 题型:填空题
(14分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | | | |||||
| | | | b | c | d | | |
| e | | f | | | g | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com