
2.80 g铁与200 mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余.向反应后的溶液中加入200 mL 0.1 mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原.求原硝酸溶液的物质的量浓度.
|
0.8 mol/L n[Fe(NO3)3]=n(I-)=0.100 L×0.2 mol/L=0.020 mol n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]= 根据电子守衡:n[Fe(NO3)3]×3+n[Fe(NO3)2]×2=n(NO)×3 0.020 mol×3+0.030 mol×2=n(NO)×3,n(NO)=0.040 mol 根据氮元素守衡:n(HNO3)=n(NO)+n[Fe(NO3)3]×3+n[Fe(NO3)2]×2=0.040 mol+0.020 mol×3+0.030 mol×2=0.16 mol c(HNO3)= |


科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 催化剂 |
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| CO |
| 高温 |
| 稀硫酸 |
| 稀硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 稀硫酸 |
| H2 |
| 高温 |
| 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
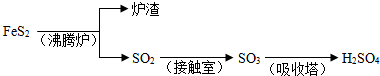
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
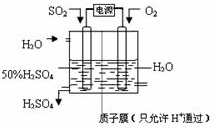
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
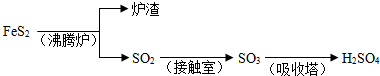
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
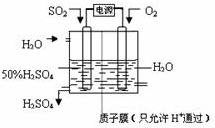
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4?7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4?7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ?7H2O的质量,你认为 (填编号),并简述所选之理由。答 。
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4?7H2O的质量。(本大题计算结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com