
 .
.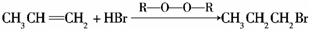 .
.分析 氯代烃A发生消去反应生成烯烃B,烯烃B被酸性高锰酸钾氧化生成CH3COOH、CO2,可推知B为CH3CH=CH2,(2)中A在核磁共振氢谱中有两组峰,且峰面积之比为6:1,则A为CH3CHClCH3,据此解答.
解答 解:氯代烃A发生消去反应生成烯烃B,烯烃B被酸性高锰酸钾氧化生成CH3COOH、CO2,可推知B为CH3CH=CH2,(2)中A在核磁共振氢谱中有两组峰,且峰面积之比为6:1,则A为CH3CHClCH3.
(1)化合物B的结构简式为CH3CH=CH2,其分子式是C3H6,1mol化合物B完全燃烧需要消耗标准状况下氧气体积为(3+$\frac{6}{4}$)mol×22.4L/mol=100.8L,0.5mol化合物B完全燃烧需要消耗标准状况下50.4L的氧气,
故答案为:50.4;
(2)A为CH3CHClCH3,在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式是 ,
,
故答案为: ;
;
(3)CH3CH=CH2在有机过氧化物(R-O-O-R)中与HBr反应的化学方程式: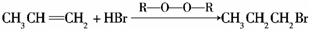 ,
,
故答案为: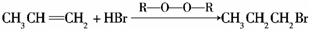 ;
;
(4)实验室检验A中是否含有氯元素,先再氢氧化钠水溶液条件下发生水解反应,再用硝酸酸化,最后加热硝酸银溶液,有白色沉淀产生,说明含有硫元素,所加试剂的顺序是:NaOH溶液、稀硝酸、AgNO3溶液,
故答案为:NaOH溶液、稀硝酸、AgNO3溶液.
点评 本题考查有机物推断,关键是根据烯烃B被酸性高锰酸钾氧化产物确定其结构,需要学生熟练掌握官能团的性质与转化,(3)中方程式书写为易错点,中学基本不涉及,难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 汽油是纯净物,有固定的熔沸点 | |
| B. | 汽油可以由石油的分馏得到 | |
| C. | 可用静置后看其是否分层来判断食用油中是否混有汽油 | |
| D. | 裂化汽油可以作为溴水中提取溴的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→ .
. 或
或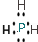 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
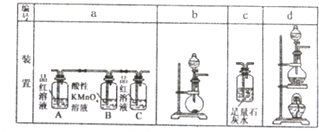 盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:
盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(3n-4) | B. | (3n-12) | C. | -(12-3n) | D. | -(n-10) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH- Mg2+ NH4+Cl- | B. | Cl- K+ Na+ Ba2+ | ||
| C. | Ba2+Cl-Cu2+ NO3- | D. | H+ Na+ CO32-Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com