
分析 (1)氯化钙增加3.6g为生成水的质量,碱石灰质量增加15.4g为生成二氧化碳的质量,根据质量守恒计算5.4g消耗氧气的质量,进而计算燃烧此有机物3.24g需消耗O2的质量;
(2)计算有机物A、二氧化碳与水的物质的量,根据原子守恒计算有机物分子中N(C)、N(H),再根据有机物的相对分子质量计算分子中N(O),进而确定有机物分子式;
(3)该有机物1分子中有1个苯环,结合分子式书写可能的结构简式.
解答 解:(1)氯化钙增加3.6g为生成水的质量,碱石灰质量增加15.4g为生成二氧化碳的质量,根据质量守恒定律,则消耗O2的质量为:3.6g+15.4g-5.4g=13.6g,燃烧此有机物3.24g需消耗O2的质量为13.6g×$\frac{3.24g}{5.4g}$=8.16g,
答:燃烧此有机物3.24g需消耗O2的质量为8.16g;
(2)5.4g 有机物A的物质的量为$\frac{5.4g}{108g/mol}$=0.05mol,生成水为$\frac{3.6g}{18g/mol}$=0.2mol,生成二氧化碳为$\frac{15.4g}{44g/mol}$=0.35mol,则有机物A分子中N(C)=$\frac{0.35mol}{0.05mol}$=7,N(H)=$\frac{0.2mol×2}{0.05mol}$=8,故分子中N(O)=$\frac{108-12×7-8}{16}$=1,则A的分子式为:C7H8O,
答:有机物A的分子式为:C7H8O;
(3)有机物A的分子式为:C7H8O,分子中有1个苯环,可能的结构简式为 ,
,
答:有机物A的可能的结构简式为: ,
,
.
点评 本题考查有机物分子式确定、同分异构体书写等,掌握燃烧热利用原子守恒确定有机物分子方法,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
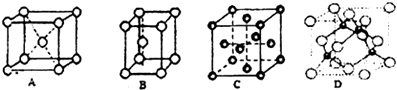
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
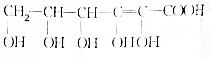 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
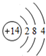 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
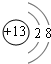 ,非金属性最强的是F.
,非金属性最强的是F.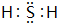 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸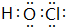 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
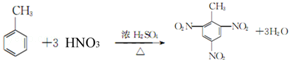
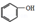 (制酚醛树脂)④
(制酚醛树脂)④ (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)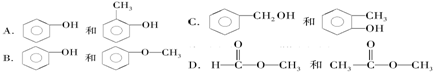
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com