

| A、c为粗铜板、d为纯铜板 |
| B、电解过程中,SO42-浓度几乎不变 |
| C、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| D、电解过程中,c电极板附近沉积不溶物,d电极板质量增加 |


科目:高中化学 来源: 题型:
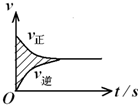 在容积固定的2L 密闭容器中进行着一个可逆反应X(g)+2Y(g)?2Z(g),用Y的物质的量浓度改变表示的反应速率v正、v逆与时间的关系如图所示.已知v的单位为mol?(L?s)-1,则图中阴影部分的面积表示( )
在容积固定的2L 密闭容器中进行着一个可逆反应X(g)+2Y(g)?2Z(g),用Y的物质的量浓度改变表示的反应速率v正、v逆与时间的关系如图所示.已知v的单位为mol?(L?s)-1,则图中阴影部分的面积表示( )| A、X的物质的量浓度的减少 |
| B、Y的物质的量浓度的减少 |
| C、Z的物质的量的增加 |
| D、Y的物质的量的减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 |
| B、BaCO3+H2SO4═BaSO4↓+CO2↑+H2O |
| C、Na2SO4+BaCl2═BaSO4↓+2NaCl |
| D、BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+2HCl═H2+FeCl2 |
| B、2FeCl2+Cl2═2FeCl3 |
| C、CaO+H2O═Ca(OH)2 |
| D、2Fe(OH)3═Fe2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ?mol-1 |
| B、已知:S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
| C、2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1 |
| D、△H>0的化学反应在高温条件下才能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com