
分析 (1)反应生成氢氧化镁沉淀;
(2)氯气与水反应生成HCl、HClO,用MnO2与浓盐酸反应制取少量Cl2,若生成标准状况下Cl22.24L,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,被氧化的HCl的物质的量等于氯气的物质的量,以此来解答.
解答 解:(1)在MgCl2溶液中滴加少量NaOH溶液,现象是有白色沉淀生成,发生反应的离子方程式是Mg2++2OH-═Mg(OH)2↓,
故答案为:有白色沉淀生成;Mg2++2OH-═Mg(OH)2↓;
(2)氯气与水反应的化学方程式为Cl2+H2O=HCl+HClO,实验室用MnO2与浓盐酸反应制取少量Cl2,若生成标准状况下Cl22.24L,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,被氧化的HCl的物质的量等于氯气的物质的量,则被氧化的HCl的物质的量为0.1mol,
故答案为:Cl2+H2O=HCl+HClO;0.1.
点评 本题考查离子反应方程式的书写及氧化还原反应的计算,为高频考点,把握发生的反应及反应中物质的量关系为解答的关键,侧重分析、应用及计算能力的综合考查,综合性较强,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 一定温度下,反应2H2O(l)═2H2(g)+O2(g)的△H>0△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量NaCl晶体,平衡逆向移动,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
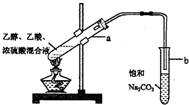
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入乙酸 | |
| B. | 饱和碳酸钠溶液可以除去乙酸乙酯中混有的乙酸 | |
| C. | 向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 | |
| D. | 将制得的乙酸乙酯分离出来,应采用“分液”的实验操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁屑与足量稀硝酸反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
| 编号 | 实验 | 现象 |
| a | 放入蒸馏水 | 木条燃烧 |
| b | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①证明KClO3具有还原性 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 实验③说明KI被氧化 | |
| D. | 上述实验证明氧化性:ClO3->Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com