
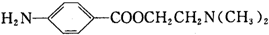 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):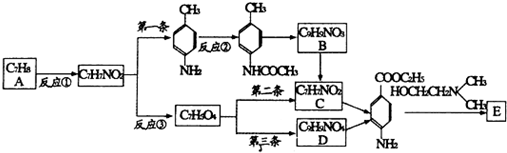
 ;C中官能团的名称是氨基和羧基.
;C中官能团的名称是氨基和羧基. ;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
;1mol该物质与NaOH溶液共热最多消耗2mol NaOH. .
.
分析 A的分子式为C7H8,结合对甲基苯胺结构,可知A为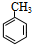 ,反应①的产物为
,反应①的产物为 ,对比反应①、③的分子式,应是甲基氧化为羧基,则反应③的产物为
,对比反应①、③的分子式,应是甲基氧化为羧基,则反应③的产物为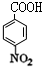 ,C、D均可以得到
,C、D均可以得到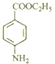 ,再对比分子式可知,C为
,再对比分子式可知,C为 ,D为
,D为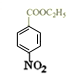 ,则B为
,则B为 ,
, 发生取代反应得到普鲁卡因E,以
发生取代反应得到普鲁卡因E,以 为原料(其他试剂任选)合成邻氨基苯甲酸甲酯,可以先将甲苯发生硝化反应生成间硝基甲苯,用高锰酸钾将甲基氧化成羧基,再用铁和盐酸将硝基还原成氨基,再与甲醇发生酯化反应即可得产品,据此解答.
为原料(其他试剂任选)合成邻氨基苯甲酸甲酯,可以先将甲苯发生硝化反应生成间硝基甲苯,用高锰酸钾将甲基氧化成羧基,再用铁和盐酸将硝基还原成氨基,再与甲醇发生酯化反应即可得产品,据此解答.
解答 解:A的分子式为C7H8,结合对甲基苯胺结构,可知A为 ,反应①的产物为
,反应①的产物为 ,对比反应①、③的分子式,应是甲基氧化为羧基,则反应③的产物为
,对比反应①、③的分子式,应是甲基氧化为羧基,则反应③的产物为 ,C、D均可以得到
,C、D均可以得到 ,再对比分子式可知,C为
,再对比分子式可知,C为 ,D为
,D为 ,则B为
,则B为 ,
, 发生取代反应得到普鲁卡因E.
发生取代反应得到普鲁卡因E.
(1)比A多一个碳原子,且一溴代物只有3种的A的同系物结构简式为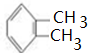 ,名称是邻二甲苯,反应①的试剂是浓硝酸、反应条件是浓硫酸作催化剂加热,
,名称是邻二甲苯,反应①的试剂是浓硝酸、反应条件是浓硫酸作催化剂加热,
故答案为:邻二甲苯;浓硝酸、浓硫酸作催化剂加热;
(2)氨基易被氧化,为防止氨基被氧化,所以设计反应②,
故答案为:保护氨基;
(3)B的结构简式为 ;C为
;C为 ,C的官能团名称为氨基和羧基,
,C的官能团名称为氨基和羧基,
故答案为: ;氨基和羧基;
;氨基和羧基;
(4)D为 ,D的同分异构体符合下列条件:①芳香族化合物,说明含有苯环;②能发生水解反应,说明含有酯基;③有3种不同环境的氢原子,其中一种结构简式为
,D的同分异构体符合下列条件:①芳香族化合物,说明含有苯环;②能发生水解反应,说明含有酯基;③有3种不同环境的氢原子,其中一种结构简式为 ,酯基水解生成的酚羟基和羧基都和NaOH反应,所以1mol该物质与NaOH溶液共热最多消耗2mol NaOH,
,酯基水解生成的酚羟基和羧基都和NaOH反应,所以1mol该物质与NaOH溶液共热最多消耗2mol NaOH,
故答案为: ;2;
;2;
(5)以 为原料(其他试剂任选)合成邻氨基苯甲酸甲酯,可以先将甲苯发生硝化反应生成间硝基甲苯,用高锰酸钾将甲基氧化成羧基,再用铁和盐酸将硝基还原成氨基,再与甲醇发生酯化反应即可得产品,反应的合成路线为
为原料(其他试剂任选)合成邻氨基苯甲酸甲酯,可以先将甲苯发生硝化反应生成间硝基甲苯,用高锰酸钾将甲基氧化成羧基,再用铁和盐酸将硝基还原成氨基,再与甲醇发生酯化反应即可得产品,反应的合成路线为 ,
,
故答案为: .
.
点评 本题考查有机合成,为高频考点,侧重考查学生分析推断能力,根据结构简式、分子式、反应条件进行推断,正确判断物质结构简式是解本题关键,难点是(5)题有机合成路线的设计,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
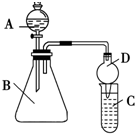 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
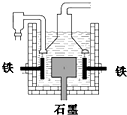 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不相同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com