
下列现象中,能用键能大小解释的是
A. 氮气的化学性质比氧气稳定 B. 常温常压下,溴呈液态,碘呈固态
C. 稀有气体一般很难发生化学反应 D. 硝酸易挥发,而硫酸难挥发
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①离子化合物含离子键,也可能含极性键或非极性键 ②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤熔融状态能导电的化合物是离子化合物 ⑥由分子组成的物质中一定存在共价键
A.①③⑤⑥ B.②④⑥ C.①②③⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业 尾气中二氧化硫的含量超过 0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
尾气中二氧化硫的含量超过 0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是________________________________________________________________________
________________________________________________________________________。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:__________________。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量__________(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如下面流程图所示:

(4)写出步骤②中反应的化学方程式________________________________________。
(5)步骤③中洗涤沉淀的方法是____________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为______________(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是__________(填字母序号)。
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2―→F的化学方程式:__________________________________。
(4)若反应F+D―→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知33As、35Br位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量,以下分析错误的是
A.将化学能转化为热能
B.其发热原理与钢铁的吸氧腐蚀相同
C.铁作负极,电极反应为:Fe – 3e → Fe3+
D.活性炭作正极,电极反应为:2H2O + O2 + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为: S+2KNO3 +3C→K2S +3CO2↑+N2↑。
请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是_________;钾元素在周期表中的位置为_________。
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是 __________________________________________________。
(3)上述反应生成物中,属于非电解质的是________(写结构式);其中熔点最高的物质的电子式是_________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.最高价氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.其两两组合形成的化合物中元素的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于烷烃与烯烃的性质及反应类型的对比中正确的是 ( )
A.烷烃只含有饱和键,烯烃只含有不饱和键
B.烷烃不能发生加成反应,烯烃不能发生取代反应
C.烷烃的通式一定是CnH2n+2,而烯烃的通式则一定是CnH2n
D.烷烃与烯烃相比,发生加成反应的一定是烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应属于加成反应的是( )
A.CH3COOH+CH3CH2OH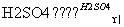 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.CH2===CH2+HCl CH3CH2Cl
CH3CH2Cl
C.2CH3CH2OH+O2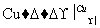 2CH3CHO+2H2O
2CH3CHO+2H2O
D.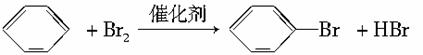
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com