
| A. | 由于白磷和红磷都是由P元素构成的且结构不同,故白磷和红磷互称为同分异构体 | |
| B. | H2O和D2O是同素异形体 | |
| C. | CH3-CH2-CH2-CH3和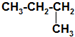 互称为同分异构体 互称为同分异构体 | |
| D. | 石英晶体是一个空间网状结构,石英晶体中不存在单个分子 |
分析 A、同分异构体是分子式相同而结构不同的化合物;
B、由同一种元素形成的不同单质互为同素异形体;
C、分子式相同而结构不同的化合物互为同分异构体;
D、石英是二氧化硅,为原子晶体.
解答 解:A、同分异构体是分子式相同而结构不同的化合物,而白磷和红磷均为单质,故不是同分异构体,是同素异形体,故A错误;
B、由同一种元素形成的不同单质互为同素异形体,而水和重水均为化合物,不是同素异形体,而是同一种物质,故B错误;
C、分子式相同而结构不同的化合物互为同分异构体,而CH3-CH2-CH2-CH3和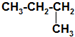 是同一种物质,故C错误;
是同一种物质,故C错误;
D、石英是二氧化硅,为原子晶体,是空间网状结构,不存在二氧化硅分子,故D正确.
故选D.
点评 本题考查了同分异构体、同素异形体和原子晶体的空间结构,难度不大.


科目:高中化学 来源: 题型:选择题
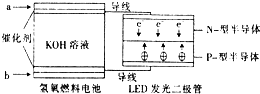 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作为相对原子质量标准的原子${\;}_{6}^{14}$C | |
| B. | 氯化镁的电子式: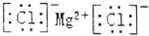 | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | HClO的结构式为:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | CO2分子的结构式:O=C=O | ||
| C. | 过氧化氢的电子式: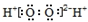 | D. | 四氯化碳分子比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的电子式为: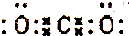 | |
| B. | 质子数为x,中子数为y的氧元素的核素符号为${\;}_{x}^{x+y}$O | |
| C. | Cl-的离子结构示意图为 | |
| D. | HClO的结构式为H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①④ | B. | 只有③⑤ | C. | 只有②③ | D. | 只有①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
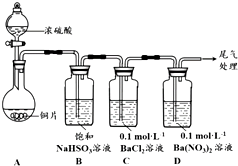 甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
甲乙两同学分别对含+4价硫元素的物质性质进行了探究.| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com