
【题目】按下图所示装置进行实验,下列现象描述正确的是(不加热)
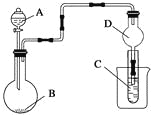
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
C.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
D.若A为浓硝酸,B为石墨,D将看到红棕色气体
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | wmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率![]() (H2)=______,此条件下该反应的平衡常数K=______。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________,且________________(用含y的等式表示)。
(H2)=______,此条件下该反应的平衡常数K=______。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________,且________________(用含y的等式表示)。
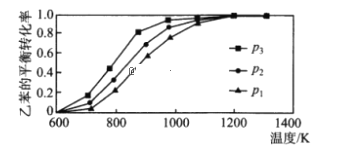
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________。
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________。
(3)CO可被NO2氧化CO+NO2 ![]() CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率![]() 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、![]() 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______。
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物化合物![]() 存在下列关系:
存在下列关系:
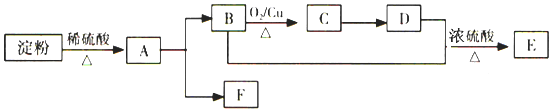
(1)写出D的官能团名称___。
(2)B+D→E的反应类型是___。
(3)反应B→C的化学方程式是___。
(4)糖类、油脂、蛋白质均为人类重要的营养物质,下列说法不正确的是:___。
A.化合物A与银氨溶液混合后,水浴加热生成银镜,说明A中存在醛基
B.油脂是高级脂肪酸和甘油形成的酯类高分子化合物,氨基酸分子中都存在氨基和羧基两种官能团
C.将绿豆大小的钠块投入B中,钠块沉在液面下,并有大量气泡产生
D.乙酸乙酯制备实验中用饱和碳酸钠溶液收集产物,乙酸乙酯在下层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容,下列物理量不再发生变化时,不能说明反应 A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A.混合气体的压强B.C的体积分数
C.混合气体的密度D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如图装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。
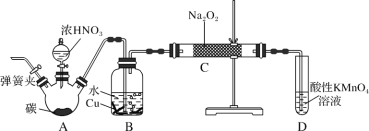
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)B中观察到的主要现象是_______,D装置的作用是_______。
(2)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是_______。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是_______ (写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以证明反应 N2+3H2![]() 2NH3 已达平衡状态的是( )
2NH3 已达平衡状态的是( )
A. 一个N≡N键断裂的同时,有三个H-H键形成
B. 一个N≡N键断裂的同时,有三个H-H键断裂
C. 一个N≡N键断裂的同时,有两个N-H键断裂
D. 一个N≡N键断裂的同时,有六个N-H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
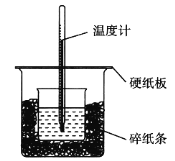
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com