
����Ŀ����һ���¶��µĺ��������еĿ��淴ӦA��g��+3B��g�� ![]() 2C��g������������������Ϊƽ���־������ ��
2C��g������������������Ϊƽ���־������ ��
��C������������C�ķֽ��������
�ڵ�λʱ��������amolA��ͬʱ����3amolB
��A��B��C��Ũ�Ȳ��ٱ仯
��A��B��C��ѹǿ���ٱ仯
�ݻ���������ѹǿ���ٱ仯
�����������ʵ������ٱ仯
��A��C�����ʵ���֮�Ȳ��ٱ仯
��A��B��C�ķ�����֮��Ϊ1:3:2
A���ڢ� B���٢� C���ڢ� D���ۢ�
���𰸡�A
��������
���������������C��������C�ֽ��������ȣ����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ѡ�������۷�Ӧ�Ƿ�ﵽƽ��״̬�����ڵ�λʱ��������a molAͬʱ����3a molB�����Բ��ܸ��ݴ����ж�ƽ��״̬����ѡ����A��B��C��Ũ�Ȳ��ڱ仯ʱ�����淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ѡ����A��B��C��ѹǿ���ٱ仯˵����Ӧ�ﵽƽ��״̬������ѡ�����÷�Ӧǰ�����������֮�ͼ�С������������ѹǿ���ٱ仯ʱ˵����Ӧ�ﵽƽ��״̬������ѡ�����÷�Ӧǰ�����������֮�ͼ�С���������������ʵ������ڱ仯ʱ���淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ѡ����A��C�ֱ��Ƿ�Ӧ�����������������ʵ���֮�Ȳ��ٱ仯˵����Ӧ�ﵽƽ��״̬������ѡ����A��B��C�ķ�����֮��Ϊ1:3:2���÷�Ӧ��һ���ﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ����Բ��ܾݴ��ж�ƽ��״̬����ѡ��������������ѡA��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����(S2Cl2)�ǹ㷺������ҵ����������ӽṹ����ͼ��ʾ��������S2Cl2��һ�ֳȻ�ɫ��Һ�壬��ˮ��ˮ�⣬��������ʹƷ����ɫ�����塣����˵���������ǣ� ��

A��S2Cl2�ĽṹʽΪCl��S��S��Cl
B�� S2Cl2Ϊ���м��Լ��ͷǼ��Լ��ķǼ��Է���
C��S2Br2��S2Cl2�ṹ���ƣ��۷е㣺S2Br2>S2Cl2
D��S2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ����Ϊ�� 2S2Cl2+2H2O=SO2��+3S��+4HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�������A��B������֮��������µ�ת����ϵ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ�������������G��HΪ��ɫ������C����������塣��ش��������⣺
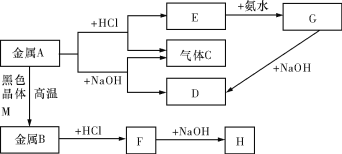
��1��д������A������D�����ƻ�ѧʽ��________________��________________��
��2��д��Eת��ΪG�����ӷ���ʽ��_____________________��
��3��д��H���ڿ����е�����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���۱�ϩ����ά��Ʒ�������ڣ�����Ϊ��������ë�����䵥���ϩ�棨C3H3N�����á���ϩ�������������������ɱ�ϩ����Ȼ�ѧ����ʽΪ��C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g) ��H=-515kJ/mol�÷����������ж��ָ���������,���б�ϩȩ��C3H4O������Ҫ������֮һ������̬��ϩ��������Ӧ����11.2g��̬��ϩȩ��ˮ������ͬʱ�ų�70.6kJ����,��Ӧ���Ȼ�ѧ����ʽΪ��___________���÷�Ӧ���κ��¶��¶����Է����У���ԭ����_____________��
��2��ͼ��a��Ϊ��ijһʱ���һ�ܱ���ϵ�����ɱ�ϩ��ķ�Ӧ�����뷴Ӧ���̵����߹�ϵ����ͼ��֪��t1ʱ�̱�ʾ��ϵ�ı�ķ�Ӧ����Ϊ_________��t2ʱ�̱�ʾ��ϵ�ı���һ��Ӧ��������ʱƽ��______�ƶ��������������������
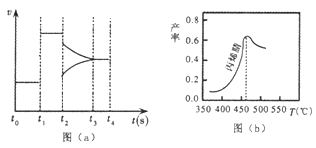
��3��ͼ(b)Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ���¶�Ϊ460�� ������ͬ�ķ�Ӧʱ���ڣ�����460��ʱ��ϩ����ʽ��͵Ŀ���ԭ����_____������ţ���
A���������Խ��� B��ƽ�ⳣ����� C.����Ӧ����
D����Ӧ������� E��ƽ�ⳣ����С
����ͬ�ķ�Ӧʱ���ڣ�����460��ʱ��ϩ��IJ���______����ǡ����ǡ�����Ӧ�¶��µ�ƽ��ת���ʣ��ж�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��������и��⣺
��1��ճ��[��Ҫ�ɷ�Al2Si2O5(OH)4] ���Ʊ��մɵ�ԭ�ϣ�������������ʽ��ʾճ�������_____________��
��2���������Ȼ���͵����������м�ǿ�ȷ�����Ӧ�����Ƶøߴ��ȵ����裬��Ӧ�Ļ�ѧ����ʽΪ_________________________��
��3���������������Բ������п�ʴ����һ�����з�����Ӧ�Ļ�ѧ����ʽΪ_______��
��4�����������ھ�ˮ����˵��ԭ��________________________��
��5����ͼ����A��B��C�о���ͬһ�ֳ�������Ԫ�أ���Ԫ����C������������ʽ���ڣ� B�ǰ�ɫ��״������

��ʵ�����г���A��ij����Һ��Ӧ�Ʊ�B,��д���÷�Ӧ�����ӷ���ʽ _________________��
��A��CҲ���Է�Ӧ����B,��д����Ӧ�����ӷ���ʽ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��298K��101kPa�����£������·�Ӧ��
��Ӧ��C(s) + O2(g) = CO2(g) �� H1����393.5 kJ��mol��1
��Ӧ��2C(s) + O2(g) = 2CO(g) �� H2����221 kJ��mol��1
��Ӧ��N2(g) + O2(g) = 2NO(g) �� H3����180.5 kJ��mol��1
�Իش��������⣺
��1������β������ԭ��Ϊ��Ӧ����2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) �� H��______���÷�Ӧ���Է����е�������_______��������¡��������¡��������¶ȡ�����
N2(g) + 2CO2(g) �� H��______���÷�Ӧ���Է����е�������_______��������¡��������¡��������¶ȡ�����
��2�������һ���¶��£����Ϊ 2 �����ܱ������з�����ѧ��Ӧ����0��4min���������ʵ����ı仯���±���ʾ��
���ʣ�mol�� ʱ�� | NO | CO | N2 | CO2 |
��ʼ | 0.40 | 1.0 | ||
2 min ĩ | 2.0 | 0.80 | 1.6 | |
4 min ĩ | 1.6 |
���� 0��2min ���� CO ����ʾ��ƽ����Ӧ���� v��CO��=________��
���Լ�����¶��·�Ӧ�� �Ļ�ѧƽ�ⳣ�� K=_________��
��3����һ���¶��£����ݻ��ɱ���ܱ������У�������Ӧ���ﵽƽ��״̬����ʱ�ݻ�Ϊ3L�� c(N2)��ʱ�� t �ı仯���� x ��ͼ��ʾ��
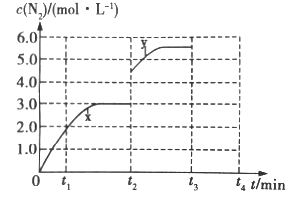
������ t2minʱ�ı�һ��������c(N2)�淴Ӧʱ�� t �ı仯������ y ��ʾ����ı��������______��
������t2minʱ�����¶ȣ�t3minʱ���´ﵽƽ�⣬����ͼ�л����� t2��t4 �� c(N2)�ı仯����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������Ų�Ϊ1s22s22p63s23p1��Ԫ������ܵļ�̬�ǣ� ��
A.+1
B.+2
C.+3
D.��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��й�˵������ȷ����(����)

A. Ԫ��b�ĵ��ʲ������������������ѧ��Ӧ
B. a��b��d��f����Ԫ�ص����Ӱ뾶��f>d>a>b
C. Ԫ��c��������������ᷴӦ������Ӧ
D. a��c��e������������Ӧ��ˮ����֮���ܹ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������NaCl��MgCl2��AlCl3������Һ�ֱ������������ʵ���Ũ�ȵ�AgNO3��Һǡ����ȫ��Ӧ����NaCl��MgCl2��AlCl3������Һ�����ʵ���Ũ��֮����
A��1:2:3 B��3:2:1 C��6:3:2 D��1:1:1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com