
【题目】已知某反应aX(g)+bY(g)=cZ(g)的各物质浓度数据如下:
X | Y | Z | |
起始浓度(molL-1) | 0.3 | 0.5 | 0 |
5s末浓度(molL-1) | 0.1 | 0.4 | 0.3 |
据此可推算出上述化学方程式中X、Y、Z三种物质的化学计量数之比是( )
A.2:1:3
B.3:1:2
C.1:4:3
D.3:2:1
科目:高中化学 来源: 题型:
【题目】实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
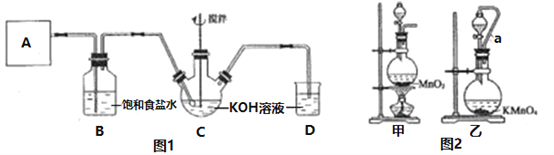
回答下列问题:
(1)装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是________,若选用装置乙,其中的导管a的作用是________。
(2)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是________;在通入氯气的过程中,不断搅拌的目的是_____________。
(3)制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为______,反应的离子方程式是____________。
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3mol/LKOH溶液中________(填操作名称),将滤液置于冰水浴中,再加入______,搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川师范大学化学与材料学院对“铁与水蒸气反应”实验研究的结果显示:在80~100℃能产生稳定水蒸气的物质都可以作为该反应的供水剂;铁与水蒸气反应温度在500℃左右即可顺利进行。
某化学兴趣小组同学利用该研究结论,采用西红柿(或洋葱)作为供水剂,设计了如图装置进行实验,并对铁与水蒸气反应的产物进行检验。

回答下列问题:
(1)A中铁与水蒸气反应的化学方程式是_______________。
(2)C中碱石灰的作用是______________。
(3)D处实验现象为___________________________。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:

①加入稀硫酸发生的离子方程式为______________________________。
②试剂A是_____________(选填字母),现象2为___________________。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为_____(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
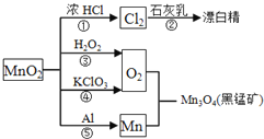
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
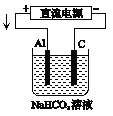
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类错误的是( )
A.混合物:盐酸、生铁、空气
B.化合物:CaCl2、NaOH、HCl
C.碱:苛性钠、纯碱、氢氧化钾
D.单质:Ca、O3、石墨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com