
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
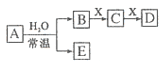
A. 若A 是单质,B和D 的反应是OH-+HCO3-=H2O+ CO32-,则E一定能还原Fe2O3
B. 若D为CO,C能和E反应,则A一定为Na2O2
C. 若X是Na2CO3,C为CO2,则A一定是氯气,且D和E不反应
D. 若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH 步骤中,溶液pH的调节范围是________。
(2)滤渣1和滤渣3 主要成分的化学式分别是________、________。
(3)写出氧化步骤中加入H2O2 发生反应的离子方程式________。
(4)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为________g。(保留小数点后1位有效数字)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体的部分结构为正三棱柱(如图所示),这种晶体中A,B,C三种微粒数目之比为( ) 
A.3:9:4
B.1:4:2
C.2:9:4
D.3:8:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为镁-间二硝基苯电池的工作原理示意图。已知:电池放电时,铁转化为氢氧化镁,间二硝基苯则转化为间苯二胺。下列说法不正确的是
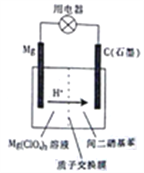
A. 电池放电时,电子由镁电极流出经过用电器流向石墨电极
B. 电池放电时,镁电极附近的电解质溶液的pH降低
C. 电池放电时,理论上每生成1mol间苯二胺就有12molH+通过质子交换膜
D. 电池放电时,石墨电板上发生的反应为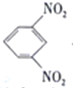 +12H+-12e-=
+12H+-12e-=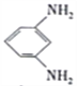 +4H2O
+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:______________________。
(2)装置B的作用是_______________________。如果B中长颈漏斗液面上升,则说明____________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入________。(选a或b或c)
a | b | c | |
I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氧的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是_______________________________。该现象______(填“能”或“不能”)说明溴的非金属性强于碘,原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
(1)该实验反应物与生成物有机物的官能团种类有(填写名称).
(2)试管a中加入几块碎瓷片的目的是 .
(3)试管a中发生反应的化学方程式为 , 反应类型是 .
(4)反应开始前,试管b中盛放的溶液是 . 作用是 .
(5)反应结束后,振荡试管b,静置.反应结束后,试管b内的液体分成两层,乙酸乙酯在层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯.以上各物质的沸点如下:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A.烧碱溶液 B.浓硫酸 C.饱和食盐水 D.浓盐酸
请回答下列问题:
(1)乙醇的沸点比丙酮沸点高的主要原因是 .
(2)加入甲溶液是 , (填A B C D序号),涉及到的反应方程式: .
(3)在70℃~85℃时馏出物的主要成分为 .
(4)在步骤④中加入过量的乙溶液是 . (填A B C D序号),
(5)最后蒸馏的温度控制在 .
(6)在蒸馏操作中,仪器选择及安装都正确的是:(填标号)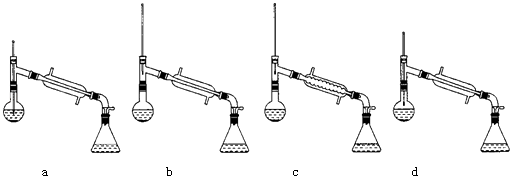
如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理? .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com