
分析 (1)根据Na2FeO4在水溶液中阴离子水解平衡移动的影响因素结合实际应用来判断;
(2)根据反应信息知道:反应物是金属锌、高铁酸钠、产物是氢氧化铁、氢氧化锌来书写方程式;
(3)根据元素守恒和电荷守恒结合反应的过程来计算回答.
解答 解:(1)Na2FeO4在水溶液中会发生水解,并且水解后溶液呈碱性,如果在氢氧化钠溶液中,NaOH溶液呈碱性,会抑制其水解,有利于减少产品损失,
故答案为:Na2FeO4 在水溶液中水解后溶液呈碱性,NaOH溶液呈碱性会抑制其水解,有利于减少产品损失;
(2)根据反应信息知道:反应物是金属锌、高铁酸钠、产物是氢氧化铁、氢氧化锌,配平后的方程式为3Zn+2Na2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4NaOH,
故答案为:3Zn+2Na2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4NaOH;
(3)n(NO)=$\frac{2.688L}{22.4L/mol}$=0.12mol,溶液中还有H+,说明硝酸未反应完,所以溶液中只含Fe3+,溶液中有n(NO3-)=200mL×4mol•L-1/1000mL•L-1-0.12mol=0.68mol,根据电荷守恒 n(NO3-)×1=n(H+)×1+n(Fe3+)×3,n(Fe3+)=0.2mol,样品中所有铁元素物质的量为0.2mol.
设样品中Fe的物质的量为x,Fe3O4的物质的量为y
56g•mol-1×x+232g•mol-1×y=13.12g
x+3y=0.2mol,
解得:x=0.11mol,y=0.03mol
单质铁的质量分数为$\frac{56g•{mol}^{-1}×0.11mol}{13.12g}×$100%=0.47,
答:质量分数为0.47.
点评 本题综合考查学生盐的水解原理以及应用、原电池的工作原理以及元素以及化合物性质的计算等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑦ | C. | ④⑥ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用FeCl2、Cu2O、NaI等物质均能使题中反应发生 | |
| B. | 若用Na2S使题中反应发生则氧化过程的反应式一定为S2-+4H2O-8e-═SO42-+8H+ | |
| C. | 当收集到2.24 L(标准状况下)气体时,参与反应的HNO3为0.1 mol | |
| D. | 若将上述氧化还原反应设计成原电池,则题中反应在负极发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的铁是光亮的银白色金属 | |
| B. | 铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性 | |
| C. | 铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态 | |
| D. | 纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
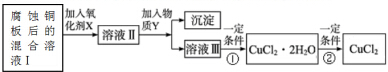
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
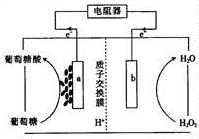 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )| A. | 该电池可以在高温条件下使用 | |
| B. | H+通过交换膜从b极区移向a极区 | |
| C. | 电极a是正极 | |
| D. | 电池负极的电极反应式为C6H1206+H20-2e一═C6H1207+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加热两种样品,没有残留物质是NaHCO3 | |
| B. | 分别配成溶液,再加入石灰水,无白色沉淀生成的是NaHCO3 | |
| C. | 分别配成溶液,向其中逐滴加入同浓度的盐酸反应,先产生CO2的是NaHCO3 | |
| D. | 二者在一定条件下不能相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com