
����Ŀ��ij�Ż��������Ҫ�ɷ���FexS(SΪһ2�ۣ����Ⱥ���Fe2+�ֺ���Fe3+����һ�����ĸôŻ�������100mL������ǡ����ȫ��Ӧ(ע:��ʯ�������ɷֲ������ᷴӦ������������2.4g��FeCl20.425 mol��һ����H2S���壬����Һ����Fe3+��������˵����ȷ���ǣ� ��
A. 100 mL��������HC1���ʵ���Ũ��Ϊ8��5 mol/L
B. ���ɵ�H2S�����ڱ�״���µ����Ϊ5.6L
C. �ôŻ�����FexS�У�Fe2+��Fe3+�����ʵ���֮��Ϊ3 : 1
D. �������FexS��x=0��15
���𰸡�A
��������
A��������ԭ���غ���������Ũ�ȣ�B��������ԭ���غ��������������C������ת�Ƶ����غ����Fe2+��Fe3+�����ʵ���֮�ȣ� D������ת�Ƶ����غ����n��Fe3+����������ԭ���غ����n��Fe2+����������ԭ���غ㼰���ʼ�����ԭ�ӵ����ʵ������Ӷ��ó�xֵ��
n��S��=![]() =0.075mol������ת�Ƶ����غ��n��Fe3+��=
=0.075mol������ת�Ƶ����غ��n��Fe3+��=![]() =0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��A������ǡ�÷�Ӧ����FeCl2 0.425mol��������ԭ���غ��c��HCl��=
=0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��A������ǡ�÷�Ӧ����FeCl2 0.425mol��������ԭ���غ��c��HCl��=![]() =8.5mol/L��ѡ��A��ȷ��B��������ԭ�ӡ���ԭ���غ��n��H2S��=
=8.5mol/L��ѡ��A��ȷ��B��������ԭ�ӡ���ԭ���غ��n��H2S��=![]() n��HCl��=n��FeCl2��=0.425mol��V��H2S��=0.425mol��22.4L/mol=9.52L��ѡ��B����C������ת�Ƶ����غ��n��Fe3+��=
n��HCl��=n��FeCl2��=0.425mol��V��H2S��=0.425mol��22.4L/mol=9.52L��ѡ��B����C������ת�Ƶ����غ��n��Fe3+��=![]() =0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��ѡ��C����D��FexS��n��S��=0.075mol+0.425mol=0.5mol��n��Fe��=0.425mol������n��Fe����n��S��=0.425mol��0.5mol=0.85������x=0.85��ѡ��D����ѡA��
=0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��ѡ��C����D��FexS��n��S��=0.075mol+0.425mol=0.5mol��n��Fe��=0.425mol������n��Fe����n��S��=0.425mol��0.5mol=0.85������x=0.85��ѡ��D����ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ָ����������Һ�У�һ���ܴ����������������()
A. ![]() ��Һ�У�
��Һ�У�![]() ��
��![]() ��
��![]() ��
��![]()
B. ��ɫ��Һ�У�![]() ��
��![]() ��
��![]() ��
��![]()
C. �����£�![]() ����Һ�У�
����Һ�У�![]() ��
��![]() ��
��![]() ��
��![]() ��
��
D. ����KSCN��Һ�Ժ�ɫ����Һ�У�![]() ��
��![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ�ܷ����������ЧӦ������
A.FeCl2��ҺB.������������C.NaHCO3D.������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ��ϵ�е������У�NaOH��Au2O3��Na2S4O6��Na2S2O3��Au2O��H2O�����з����ж�Ӧ�����ʻ��й�������ȷ���ǣ� ��
![]()
A. Na2S4O6��H2O��Na2S2O3��Au2O��NaOH B. Na2S2O3��NaOH��Na2S4O6��Au2O��H2O
C. Na2S2O3��H2O��Na2S4O6��Au2O��NaOH D. ��1 mol Au2O3��ȫ��Ӧʱ��ת�Ƶ���8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ���ǹ������������������һ�����ʵġ�ԭ���ϡ���
��1��1869�꣬�Ž��з���ǰ���о��Ļ������Ƴ��˵�һ��Ԫ�����ڱ�����ͼ��ʾ��
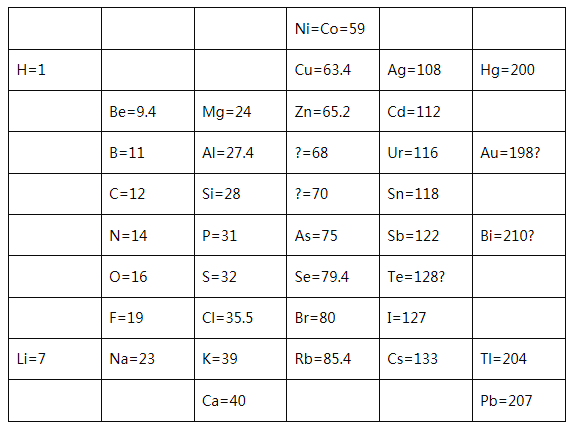
���Ž��з�����Ԫ�ذ������ԭ����������ͬһ_________������С������С���Ԫ���������ơ���ϱ�����Ϣ�������4�з����С�����70�����ʺű���ĺ�����______����5�з����С�Te��128�������ʺű���ĺ�����________��
�ڵ�20���ͳ����Ž��з����ڱ���Ϊδ֪Ԫ�����µĿ�λ�����������ң�����ԭ�ӽṹ�����أ���ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ����_____������ĸ��ţ���
A. ���ź˵����������Ԫ����Ҫ���ϼ۳��������Ա仯
B. ���ź˵����������ԭ�Ӻ�������Ų����������Ա仯
C. ���ź˵����������ԭ�Ӱ뾶���������Ա仯
��2��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�����£�
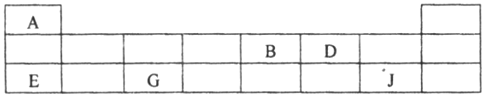
�����ϱ��ش����⣺
�ٵ������ڵ�����Ԫ�������Ӱ뾶��С����_________ ����Ԫ�ط�����𣩡�
��B��D�ķǽ������ɴ�С��˳����__________ ����Ԫ�ط�����𣩡�
��E��G��J������������Ӧˮ��������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊi.H����OH����H2O��ii.___��iii.___��
���õ���ʽ��ʾA2D�γɹ���_______________��
(3)Ԫ��Y��һ�ֺ����ữѧʽΪ H3YO3����ṹʽ�ɱ�ʾΪ��![]() ������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ_____�����ö�ӦԪ�ط������(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ_____�����ö�ӦԪ�ط������(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)Ϊ�Ϻ�ɫ��ĩ����һ������Ч��������K2FeO4������ˮ������ŨKOH��Һ����0 ��~5 ���ǿ������Һ�н��ȶ���һ���Ʊ�����������Cl2��KOH��Һ��20 �����·�Ӧ����KClO���ڽϸ��¶���������KClO3����KClO����KOH��Fe(NO3)3��Һ��Ӧ�����Ƶ�K2FeO4��ʵ��װ����ͼ��ʾ��
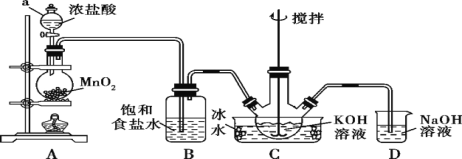
�ش��������⣺
(1)�Ʊ�KClO��
������a��������________________��װ��B���յ�������________��
��װ��C��������ƿ���ڱ�ˮԡ�е�Ŀ����______________��װ��D��������_____________��
(2)�Ʊ�K2FeO4��
��װ��C�еõ�����KClO��������ƿ�ϵĵ���ȡ�£�����KOH��Һ��Fe(NO3)3��Һ��ˮԡ���Ʒ�Ӧ�¶ȣ����裬����Һ��Ϊ�Ϻ�ɫ���÷�Ӧ�����ӷ���ʽΪ________________________________��
����װ��C�м��뱥��________��Һ�������Ϻ�ɫ���壬���ˡ�
(3)�ⶨK2FeO4���ȡ��ⶨK2FeO4�Ĵ��ȿ��õζ������ζ�ʱ�йط�Ӧ�����ӷ���ʽΪ��
a.FeO42-+CrO2-+2H2O�TCrO42-+Fe(OH)3��+OH-
b.2CrO42-+2H+�TCr2O72-+H2O
c.Cr2O72-+6Fe2++14H+�T2Cr3++6Fe3++7H2O
��ȡ2.0g�Ʊ���K2FeO4��Ʒ��������KOH��Һ�У�����������KCrO2����ַ�Ӧ����ˣ���Һ��250mL����ƿ�ж��ݣ�ȡ25.00mL����ϡ�����ữ����0.10 molL-1��(NH4)2Fe(SO4)2����Һ�ζ����յ㣬�ظ�����2�Σ�ƽ������(NH4)2Fe(SO4)2��Һ�����Ϊ24.00mL�����K2FeO4��Ʒ�Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K+��Al3+��Fe2+��Mg2+��Ba2+��NH4+��Cl-��CO32-��SO42-����ȡ����100mL��Һ��������ʵ�飺
�ٵ�һ�ݼӹ���NaOH��Һ���Ⱥ�ֻ�ռ�������0.02mol���������ɣ�ͬʱ�õ���Һ�ס�
���ڼ���Һ��ͨ�����CO2�����ɰ�ɫ���������������ˡ�ϴ�ӡ����գ�����Ϊ1.02g��
�۵ڶ��ݼ�����BaCl2��Һ�ð�ɫ������������ܽ⣬�����ˡ�ϴ�ӡ�����Ƶó�������Ϊ13.98g��
��1��������ʵ���ȷ����Һ��һ�������ڵ�������______________������ȷ���Ƿ���ڵ�������_______�������������ʹ�ú����Լ���______________��
��2���������֪����Һ��________�ԣ������ԡ����Ի����ԣ����������������м��ܱ��������ܱ���ԭ��������___________��
��3���������Ƿ���ڣ��ǻ��_______����������Ũ�ȷ�ΧΪ��û���𣩣�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ͬѧ������ͼ��ʾװ��(�гּ�����װ������ȥ��װ������������)̽��SO2������(ʵ��ǰ�����ȳ�ȥװ���еĿ���)����ش��������⣺
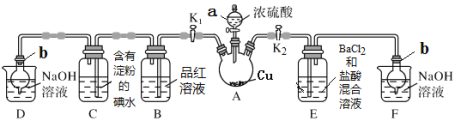
[�������ϵ�֪Ũ����ķе�Ϊ338 �棬�ƾ��ƻ�����¶�Ϊ400��500 ��]
��1������a������_________��
��2��װ��D��F��������_________��
��3������ʱ��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ________��
��4����K1���ر�K2������װ��Aһ��ʱ���B�е�������_____����װ��C����Һ����ɫ��Ϊ��ɫ���ɴ��Ʋ�������ɫ��Һ�е�������Ҫ��H����I�� ��____��Ϊ�˽�һ��ʵ��֤ʵ�˸ù�����SO2�ѱ���������ʵ������������ǣ�_____��
��5���ر�K1����K2���þƾ��Ƽ���װ��A���۲쵽E�з����������ǣ��а�ɫ������������ɫ�����ijɷ���_____�����ɰ�ɫ������ԭ�������___��ѡ����ĸ��ţ���
a��SO2��BaCl2��Һ��Ӧ�����˰�ɫ����
b��BaCl2��Һ������������Ӧ�����˰�ɫ����
c��SO2����ˮ���ɵ�H2SO3��װ���ڵ�O2��������H2SO4������BaCl2��Ӧ���ɰ�ɫ����
��6��ȡA�в�����SO2����ͨ������˫��ˮ�У�Ȼ���������BaCl2��Һ�������ˡ�ϴ�ӡ�����õ�4.66 g�������ݴ���֪SO2��������Ϊ___mL����״������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���γɵ��������ᡢ�����ᣨHNO2���ȣ�����HNO2ΪһԪ���ᡣ
��1��д��HNO2��Һ��NaOH��Һ��Ӧ�����ӷ���ʽ��______��
��2���������ƣ�NaNO2����ʳ��һ������ζ�����к�ǿ�Ķ��ԣ���ʳNaNO2��ʹ���ж�����֪���������ܷ������·�Ӧ��2NaNO2 + 4HI �T 2NO�� + 2NaI + I2 + 2H2O���÷�Ӧ��������Ԫ����______��
��3��ʵ����������0.1molL��1��NH4NO3��Һ500mL��
������ʱ��Ӧ��������ƽ��ȡNH4NO3������Ϊ_______��
�ڶ���ʱ���ӿ̶��ߣ��������Һ��Ũ��________������ƫ��������ƫ����������Ӱ��������
��4����Ũ�����з���ͭƬ������12.8 gͭ��һ������Ũ���ᷴӦ��ͭ������ʱ��������5.6 L(��״��)���壬�������ĵ�HNO3�����ʵ���Ϊ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com