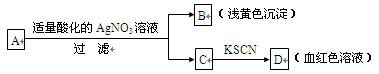
试题分析:沉淀由白色变为灰绿色又变为红褐色,这说明该白色沉淀一定是氢氧化亚铁,因此丁和乙是硫酸亚铁和氢氧化钠;将丁溶液滴入甲溶液,有白色沉淀生成,而将甲溶液滴入丁溶液时,无沉淀生成,因此丁是氢氧化钠,甲是硫酸铝,乙是硫酸亚铁,则丙是氯化钡,答案选B。
点评:常见离子的检验方法
一、常见阳离子的检验
1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
二、常见阴离子的检验
1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水。
3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。
4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。②加入氯水和淀粉试液,溶液变蓝。
5、 SO42-:加入BaCl2溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
6、 SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色。②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2)。
7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的Pb(NO3)2试纸变黑。②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS或CuS)。
8、 CO32-:①加入CaCl2或BaCl2溶液,生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊。②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀。
9、 HCO3-:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,无明显现象。
10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味的气体(NO2)。