
【题目】下列叙述错误的是
A. 用过滤法无法除去Fe(OH)3胶体中的FeCl3
B. FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成
C. 从分类的角度看,混合物、分散系、胶体的从属关系如图所示:
![]()
D. 硫酸厂附近的雨水样品在空气中放置2小时后,测得pH变小,因为样品吸收了空气中的CO2
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是
A.乙烷与氯气混合B.乙烯与氯化氢气体混合
C.乙烯与氯气混合D.乙烯通入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。

(1)下图所示的模型表示的分子中,可由A、D形成的是________。


写出c分子的空间构型为_________,d分子的结构简式 _________。
(2)关于d分子有下列问题:
①d分子中同一平面的原子最多有_______个。
②若用-C4H9取代环上的一个H原子,得到的有机物的同分异构体共有__________种。
(3)Na在F单质中燃烧产物的电子式为______。上述元素的最高价氧化物的水化物中,碱性最强的是______ (写化学式) ,其与Q的单质反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液的导电能力最强的是
A. 10mL 18.4mol/L硫酸 B. 20mL 1.0mol/L盐酸
C. 30mL 1.0mol/L醋酸 D. 40mL 1.0mol/L氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铋在汽车装饰,电子设备等生活方面有广泛的应用。利用铜转炉烟尘(主要为含铋的化合物,另外还含Cu、Pb、Bi的硫酸盐及CuS、Fe2O3)可生产氯氧化铋,其工艺流程如下:

(1)提高“酸浸”反应速率的措施有适当增加硫酸的浓度和_____________。
(2) “浸渣1”中除铋的化合物外,还有的物质是_______________(填化学式)
(3) “浸液1”中加入过量锌粉,作用是____________________;反应完毕后,过滤,从滤液中得到ZnSO4·7H2O晶体的操作有________、________、过滤、洗涤、干燥。
(4)“浸铜”时,有单质硫生成,写出生成硫的离子方程式________________________
(5)“浸铋”时,在室温和液固比(盐酸、NaCl溶液组成的混合溶液的质量与“浸渣2”的质量的比值)固定的条件下,c(HCl)=1 mol·L-1时,铋的浸出率和Cl-浓度的关系如下图所示,其中NaCl的作用是_________,若升高温度,铋的浸出率反而下降,其可能的原因是__________________________________。

(6)“沉铋”时需要控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作所对应的现象、结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 产生白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
B | 向含有酚酞的Na2CO3溶液中加入BaCl2溶液 | 溶液颜色变浅 | Na2CO3溶液中水解平衡向右移动 |
C | 用pH试纸测定NaC1和NaF溶液的pH | pH(NaC1)<pH(NaF) | F元素非金属性强于C1 |
D | 向足量FeI2溶液中滴加2滴氯水,再分别滴加①淀粉溶液②KSCN溶液 | ①溶液变蓝 ②无明显现象 | 还原性:I->Fe2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2] 是一种重要的氮肥,在工农业生产中广泛应用。
(1)工业制备尿素的反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________。
CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________。
a.平衡时,NH3的浓度为0.02 molL1
b.当v(NH3)正=2v(H2O)逆时,反应达到平衡状态
c.若在恒温恒压条件下充入稀有气体,平衡发生正向移动
d.加入适当的催化剂可提高CO2的转化率
(2)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是___________;碳酸铵溶液中离子浓度由大到小的顺序为_____________;如果将一定浓度的碳酸铵溶液加入到相同浓度的稀BaCl2和ZnCl2混合液中,首先析出的沉淀是__________。(已知Ksp(BaCO3)=5.1×10-9mol2L-2,Ksp(ZnCO3)=1.4×10-11 mol2L-2)
(3)用甲醛法可以间接测定尿素含氮量。尿素通过处理转化为铵盐,甲醛与NH4+作用,其反应如下:4NH4++6HCHO=(CH2)6N4H++3H++6H2O。所生成的H+和(CH2)6N4H+都可与NaOH溶液反应,用NaOH标准溶液滴定时采用酚酞作指示剂。
称取Wg尿素样品,经转化后得到1000mL溶液,量取25.00mL放入锥形瓶中,滴加2滴酚酞,用0.1000molL-1NaOH标准溶液滴定,滴定至终点时,消耗碱液体积20.50mL。
① 滴定至终点的现象是__________________________。
② 该尿素样品的纯度为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A. 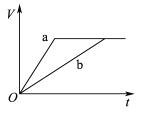 B.
B. 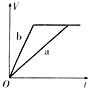
C. 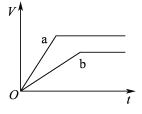 D.
D. 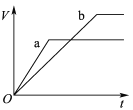
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com