
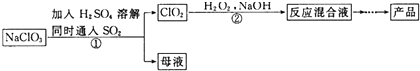
分析 NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,然后与过氧化氢在碱性条件下反应生成NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO3,
(1)根据影响反应速率的因素采取合适的措施;
(2)反应①为NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,根据元素守恒和电荷守恒书写离子方程式,根据方程式可计算出电子转移数目;
(3)步骤②ClO2与过氧化氢在碱性条件下反应生成NaClO2,根据化合价的变化可知,双氧水将ClO2还原成NaClO2;蒸发操作通常要用到酒精灯,蒸发皿,玻璃棒等;
(4)根据NaClO2和NaCl的总质量及钠的元素的总物质的量列方程组可求得NaClO2的物质的量;
解答 解:(1)根据影响反应速率的因素可知,要加快步骤①的反应速率可以升高温度或增大硫酸的浓度等,
故答案为:升高温度或增大硫酸的浓度;
(2)NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,方程式为2ClO3-+SO2=2ClO2+SO42-,每生成22.4L ClO2,即1mol,反应中Cl元素化合价由+价降低到+4价,则转移1mol电子,
故答案为:2ClO3-+SO2=2ClO2+SO42-;NA;
(3)NaClO2与过氧化氢在碱性条件下反应生成NaClO2,方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,根据化合价的变化可知,双氧水的作用是还原剂,蒸发操作通常要用到酒精灯,蒸发皿,玻璃棒等,
故答案为:还原剂;酒精灯,蒸发皿,玻璃棒;
(3)从“亚氯酸钠溶液”到“粗产品”需经过的操作依次是蒸发(浓缩)、(冷却)结晶、过滤,
故答案为:蒸发(浓缩);(冷却)结晶;过滤;
(4)设NaClO2的物质的量为xmol,NaCl的物质的量为ymol,根据题意有$\left\{\begin{array}{l}{x+y=n}\\{90.5x+58.5y=w}\end{array}\right.$,解得x=$\frac{w-58.5n}{32}$,即NaClO2的物质的量为$\frac{w-58.5n}{32}$,
故答案为:$\frac{w-58.5n}{32}$.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 872KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Q | R | ||
| T | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | Cl2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | NO2 | SO2 | BaCl2 |
| A. | ①②③④⑤ | B. | 只有②③④ | C. | 只有①③④ | D. | ①②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢元素有三种同位素,则氢气分子有三种 | |
| B. | 稀有气体元素原子最外层都达到8电子稳定结构 | |
| C. | 第IA、ⅡA族元素的阳离子与同周期稀有气体元素原子具有相同的核外电子排布 | |
| D. | 将盛有NH4HCO3粉末的小烧杯放人盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固,该反应中,热能转化为产物内部的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com