
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 标准状况下,22.4LBr2中所含分子数为NA | |
| C. | 12.0NaHSO4晶体中含阳离子数目为0.1NA | |
| D. | 7.8gNa2O2与足量 的水反应转移电子数目为0.2NA |
分析 A、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol碳氧双键来分析;
B、标况下溴为液态;
C、求出硫酸氢钠的物质的量,然后根据1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根来分析;
D、求出过氧化钠的物质的量,然后根据过氧化钠与水反应时,1mol过氧化钠转移1mol电子来分析.
解答 解:A、22g二氧化碳的物质的量为0.5mol,而1mol二氧化碳中含2mol碳氧双键,故0.5mol二氧化碳中含1mol碳碳双键即NA个,故A错误;
B、标况下溴为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、12.0g硫酸氢钠的物质的量为0.1mol,而1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根,故01mol中含阳离子为0.1NA个,故C正确;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠与水反应时,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100mL、1mol•L-1的AlCl3溶液中,含Al3+的数目为0.1NA | |
| B. | 46g乙醇中所含共价键的数目为8NA | |
| C. | 1mol氧气与足量金属钠反应,氧气一定得到4NA个电子 | |
| D. | 100mL、18.4mol/L的硫酸与足量铜反应,生成二氧化硫的分子数0.92NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于N | |
| B. | 断开X、Y中的化学键吸收的能量大于形成M、N中化学键放出的能量 | |
| C. | X、Y的总能量一定高于M、N的总能量 | |
| D. | 因该反应是放热反应,故不加热一定可以反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
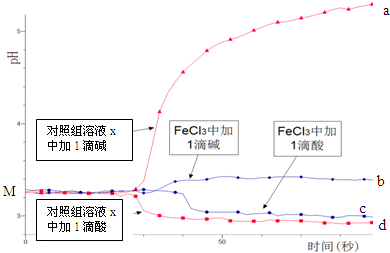
| A. | 依据M点对应的pH,说明Fe3+发生了水解反应 | |
| B. | 对照组溶液x的组成可能是0.003 mol/L KCl | |
| C. | 依据曲线c和d说明Fe3+水解平衡发生了移动 | |
| D. | 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中含Na+、不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色 | 溶液中含有Fe2+、没有Fe3+ |
| C | 向苯中滴入少量浓溴水、振荡,静置,溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
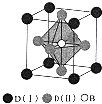 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+(用离子方程式表示);
NH3•H2O+H+(用离子方程式表示); Ca2+(aq)+CuA(s).
Ca2+(aq)+CuA(s).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com