
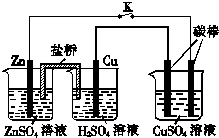
| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
分析 连接K后,左侧两个烧杯形成原电池,锌为负极,发生氧化反应,铜为正极,发生还原反应,电解方程式为2H++2e-═H2↑,右侧烧杯为电解池,与锌相连接的为阴极,与铜连接的为阳极,总方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2 ↑+2H2SO4,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,以此解答该题.
解答 解:A.Cu活泼性比Zn弱,作正极,正极上氢离子得电子生成氢气,则其电极反应式为2H++2e-═H2↑,故A正确;
B.烧杯右侧碳棒与原电池负极相连为阴极,阴极上阳离子得电子,即铜离子得电子析出铜单质,故B正确;
C.右侧烧杯中反应为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2 ↑+2H2SO4,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,已知Zn-2e-═Zn2+,则溶解的Zn为0.1mol,即6.5g,故C正确;
D.由题目可知,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,故D错误.
故选D.
点评 本题考查电解原理,为高频考点,把握“加入0.1mol CuO充分反应后,溶液恰好恢复到电解前的状态”发生的电解反应为解答的关键,侧重电极反应、原子守恒及转移电子计算的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 大量食用纯碱可使钙离子沉淀完全,预防胆结石产生 | |
| B. | 不食用含钙的食品 | |
| C. | 适量服用维生素E、维生素C等抗氧化自由基可预防胆结石 | |
| D. | 手术切除胆囊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol.L-1 NaOH溶液:K+、SO42-、CO32- | |
| B. | 0.1 mol.L-1 NaOH溶液:NH4+、Cl-、HCO3 - | |
| C. | PH=1的溶液中:Fe2+、NO3 -、Ba2+ | |
| D. | 0.1 mol.L-1 Na2CO3溶液:Ca2+、NO3 -、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫粉在过量的纯氧中燃烧可以生成三氧化硫 | |
| B. | 用饱和碳酸钠溶液除去二氧化碳中的二氧化硫 | |
| C. | 等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3 | |
| D. | 过量的铁在氯气中燃烧生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中除短周期外,其他周期均有18种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 副族元素中没有非金属元素 | |
| D. | 碱金属元素是指IA族的所有元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验试液中的SO42-:试液$\stackrel{足量稀硝酸}{→}$无沉淀$\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| B. | 检验试液中的SO32-:试液$\stackrel{浓盐酸}{→}$气体$\stackrel{品红}{→}$褪色 | |
| C. | 检验试液中的I-:试液$\stackrel{H_{2}O_{2}}{→}$棕黄色溶液$\stackrel{浓粉溶液}{→}$蓝色溶液 | |
| D. | 检验试液中的CO32-:试液$\stackrel{足量BaCl_{2}溶液}{→}$白色沉淀$\stackrel{足量稀盐酸}{→}$沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com