
| 实 验 用 品 | 溶 液 温 度 | △t | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
| ③ | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 25.5℃ | |
| Q |
| n |
| 1.4212KJ×1mol |
| 0.025mol |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 1 |
| 2 |
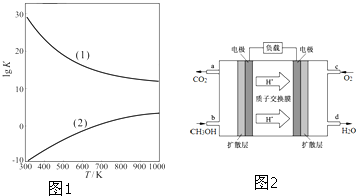
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |
| 盐酸 | NaOH | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
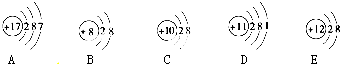
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸不小心滴到大理石桌面上,桌面失去光泽 |
| B、熏醋可一定程度上防止流行性感冒 |
| C、醋可以除去水壶上的水垢 |
| D、用醋烹饪鱼,除去鱼的腥味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| B、14g N2中含有的原子数为NA |
| C、标准状况下,54mL H2O中含有的分子数为3NA |
| D、2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com