
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液中存在电荷守恒,CH3COOK溶液中加入少量NaNO3固体后溶解c(Na+)=c(NO3-);
B.新制氯水中存在化学平衡,Cl2+H2O?HCl+HClO,次氯酸是弱酸存在电离平衡,溶液显酸性;
C.溶液中存在物料守恒和电荷守恒分析判断;
D.0.1mol•L-1,pH为4的NaHB溶液显酸性,说明HB-电离大于水解.
解答 解:A.溶液中存在电荷守恒,c(K+)+c(H+)+c(Na+)=c(CH3COO-)+c(OH-)+c(NO3-),CH3COOK溶液中加入少量NaNO3固体后溶解c(Na+)=c(NO3-)得到,c(K+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.新制氯水中存在化学平衡,Cl2+H2O?HCl+HClO,次氯酸是弱酸存在电离平衡,溶液显酸性,离子浓度大小为c(H+)>c(Cl-)>c(ClO-)>c(OH-),故B错误;
C.NH4HSO4溶液中电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),c(SO42-)=c(NH4+)+c(NH3•H2O),c(H+)=c(NH4+)+2c(NH3•H2O)+c(OH-),故C错误;
D.0.1mol•L-1,pH为4的NaHB溶液显酸性,说明HB-电离大于水解,c(HB-)>c(B2-)>c(H2B),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
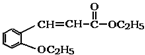 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为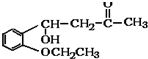 )其合成路线如图:
)其合成路线如图:
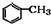 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$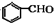
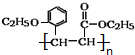 .
.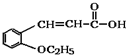 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$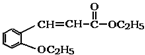 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
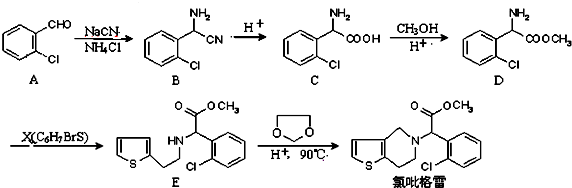
 .
. .
.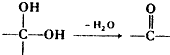
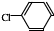 中氯原子较难水解
中氯原子较难水解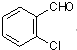 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、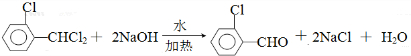 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式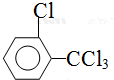 、
、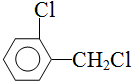 .
.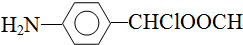 .
.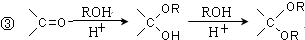
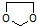 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: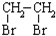
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
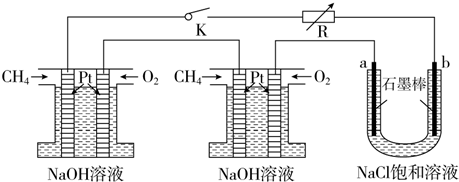
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量石灰乳吸收工业尾气中的SO2:Ca2++2OH-+SO2═CaSO3↑+H2O | |
| B. | 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解NaCl溶液:2C1-+2H2O$\frac{\underline{\;高温\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 将Fe2O3加入到HI溶液中:Fe2O3+6H+═2Fe3++3H2O↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是
东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿乃中药,宜采取水煎煮熬汁的方法服用 | |
| C. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取 | |
| D. | 青蒿素分子中有2种非极性键和3种极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如五氧化二磷和硅胶 | |
| B. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 利用太阳能电池板发电,不发生化学变化 | |
| D. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O含有电子数为10NA | |
| B. | 常温下,4.6 g Na和足量的O2完全反应失去电子数为0.2NA | |
| C. | 标准状况下,11.2 LNO和11.2 L O2混合后气体的分子总数为NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com