
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:设计必修二化学苏教版 苏教版 题型:022
有一硝酸盐晶体,其化学式表示为M(NO3)x·nH2O,经测定其摩尔质量为242 g·mol-1.取1.21 g该晶体溶于水配成100 mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01 mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32 g.
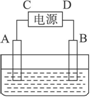
完成下列问题:
(1)金属M的相对原子质量为________,x=________,n=________.
(2)C极为________极.
(3)电解后溶液的H+浓度为(设电解前后溶液的体积不变________.
查看答案和解析>>
科目:高中化学 来源:必修二高手化学苏教版 苏教版 题型:022
有一硝酸盐晶体,其化学式表示为M(NO3)x·nH2O,经测定其摩尔质量为242 g·mol-1.取1.21 g该晶体溶于水配成100 mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01 mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32 g.完成下列问题:
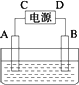
(1)金属M的相对原子质量为________,x=________,n=________.
(2)C极为________极.
(3)电解后溶液的H+浓度为设电解前后溶液的体积不变)________.
查看答案和解析>>
科目:高中化学 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
请按要求回答下列问题:
(1)将0.20 mol CH4和0.30 mol H2O(g)通入容积为2 L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如下图.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)________;ΔH1________0,p1________p2(均填“<”、“=”或“>”);p1、100℃时平衡常数的值K=________.

(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.

若在300℃时其他条件不变,将该反应容器容积压缩到原来的1/2,重新平衡时CH3OH的物质的量的变化是________,K的变化是________(均填“增大”,“减小”或“不变”).
(3)已知在常温常压下:2CH3OH(I)+3O2(g)![]() 2CO2(g) ΔH=-1275.6 kJ/mol
2CO2(g) ΔH=-1275.6 kJ/mol
H2O(g)=H2O(I) ΔH=-44.0 kJ/mol,请计算32 g新型燃料甲醇完全燃烧生成液态水放出热量为________kJ.
(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如下图所示,电池工作时电子移动方向是(极板用M、N表示)________,负极电极反应式为________.

若以该燃料电池作为电源,用石墨作电极电解500 mL饱和食盐水,当两极共收集到1.12 L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=________(假设反应前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)金属M的相对原子质量为____________,x=____________,n=____________。
(2)C极为____________极。
(3)电解后溶液的H+浓度为____________(设电解前后溶液的体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:

完成下列问题:
(1)金属M的相对原子质量为___________,x=___________,n=___________。
(2)C极为___________极。
(3)电解后溶液的H+浓度为(设电解前后溶液的体积不变___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com