
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1,| 化学键 | C-O | C-H | H-H | C≡O | O-H |
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol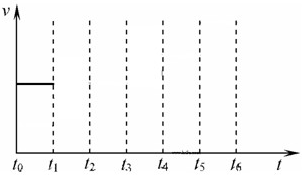 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2+O2═2NO | N2+3H2═2NH3 | |||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 200 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:填空题
大气固氮和合成氮是周氮的重要形式。下表是大气固氮和合成氨的部分K值:
|
|
N2+O2 |
N2+3H2 |
||
|
温度 |
25℃ |
2000℃ |
25℃ |
400℃ |
|
平衡常数K |
3.84×10-31 |
0.1 |
5×108 |
200 |
(1)大气固氮是_______(“吸热”、“放热”)反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是______________________________________。
(2)工业合成氨原料气的制备主要方法如下:
①以空气为原料制备N2,其方法是______________________________________。
②以焦炭和水为原料制备H2,反应原理为____________________、__________________。
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:
CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC·CO(aq)+Q(Q>0)
Cu(NH3)2AC·CO(aq)+Q(Q>0)
要从除杂后的溶液中“再生”出醋酸亚铜氨,可________(“升”“降”)温、____(“增”“降”)压。
(3)液氨和水类似,也能自离解(电离):NH3+NH3 NH4++NH2-。
NH4++NH2-。
①液氨的离子积可以表示为________________。
②25℃时,液氨的离子积K=1.0×10-30。若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)_________ (选填编号)
a.c(Na+)=c(NH2-) b.c(NH4+)·c(NH2-)=1.0×10-30 c.c(NH2-)> c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省、二中高三上学期期末联考化学试卷(解析版) 题型:填空题
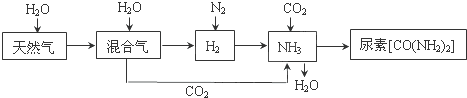
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。

(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染。
已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g)=2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的_____倍(计算结果保留1位小数)。
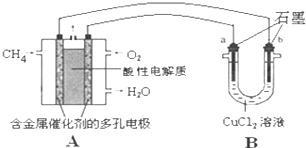
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的正极反应式是____ ____。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(4)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com